-
化学与我们的生活息息相关。下列描述正确的是( )
A.SO2具有漂白性,可用过量的SO2漂白薯片
B.Fe2O3俗称铁红,常作红色油漆和涂料
C.BaCO3可与胃酸反应,可作抗酸药物
D.明矾水解产生胶体,常用于水体消毒
难度: 中等查看答案及解析
-
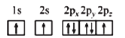
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y的最高正价与最低负价的代数和为2,W的简单阳离子半径在同周期的 主族元素中最小,Q的原子半径在同周期的主族元素中最小。下列说法正确的是( )
A.简单离子半径:Y<Z<W<Q
B.W和Q组成的二元化合物含有离子键
C.Z和W组成的二元化合物既能与强酸反应,又能与强碱反应
D.简单氢化物的沸点:Q>Z
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCl2溶于水生成Cl-的数目为0.5NA
B.常温常压下,3.4g羟基(-OH)所含的电子数目为1.8NA
C.等物质的量的A1分别与足量盐酸和NaOH溶液反应,转移的电子数均为3NA
D.25℃时,1LpH=8的CH3COONa溶液中,水电离出的OH-数目为10-8NA
难度: 中等查看答案及解析
-
有机物
是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
A.分子式为C11H10
B.—氯代物有5种(不考虑立体异构)
C.不能形成高分子化合物
D.1mol该化合物最多能与3molH2发生加成反应
难度: 中等查看答案及解析
-
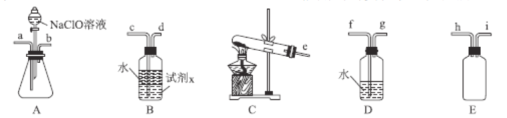
根据下列实验操作和现象得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
甲烷与
在光照下反应
产物能使湿润的蓝色石蕊试纸变红
氯代烷在水中电离出
B
向填有硫酸处理的
硅胶导管中吹入乙醇蒸气
固体由橙色变为绿色
乙醇具有氧化性
C
向
溶液中缓慢通入
气体
产生黑色沉淀
硫酸的酸性弱于
D
将金属钠在燃烧匙中点燃,迅速伸入集满
的集气瓶中
产生大量白烟,瓶内有黑色颗粒产生
能与
发生置换反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
铅氧化还原液流电池作为一种新型铅电池,具有一定的应用前景,正在逐渐成为电化学储能领域的一个研究热点。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是( )
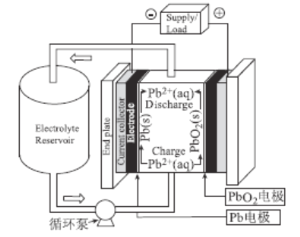
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,正极反应式为PbO2+4H++2e-=Pb2++2H2O
C.充电时,阴极反应式为2H++2e-=H2↑
D.该电解液可用稀H2SO4替代,放电效果相同
难度: 中等查看答案及解析
-
常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )
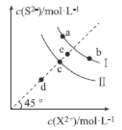
A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
难度: 中等查看答案及解析
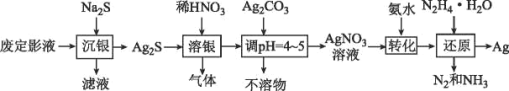
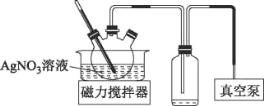
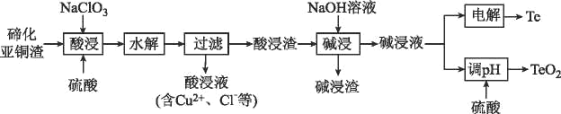
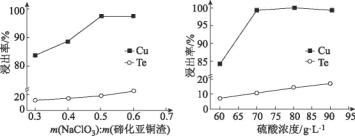

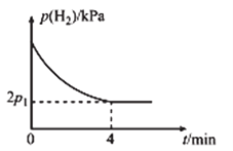
 B.
B.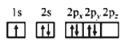
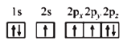 D.
D.