-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族Y、Z的原子最外层电子数之和等于8,X的简单氢化物与W的简单氢化物反应有大量白烟生成。下列说法正确的是
A. 简单离子半径:Y<Z<W
B. Z与W形成化合物的水溶液呈碱性
C. W的某种氧化物可用于杀菌消毒
D. Y分别与X、Z形成的化合物,所含化学键的类型相同
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.古代的鎏金工艺利用了电解原理
B.“丹砂(HgS)烧之成水银,积变又还成丹砂”互为可逆反应
C.古代所用“鼻冲水”为氨水,其中含有5种微粒
D.“凡酸坏之酒,皆可蒸烧”中涉及蒸馏操作
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.20 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+数为2NA
C.标准状况下,22.4 L水中含有的共价键数为2NA
D.50 mL 12 mol·L-1的浓盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.甲烷有两种二氯代物
B.1 mol CH2=CH2中含有的共用电子对数为5NA
C.等物质的量的甲烷与氯气在光照条件下反应的产物是CH3Cl
D.邻二甲苯只有一种结构说明苯分子不是由单双键交替组成的环状结构
难度: 简单查看答案及解析
-
下列对有关实验操作及现象的结论或解释正确的是
选项
实验操作
实验现象
结论或解释
A
向H2O2溶液中滴加FeCl3溶液
产生大量气泡
FeCl3催化 H2O2的分解
B
将酸性KMnO4溶液滴入丙烯醛中
溶液的紫红色褪去
丙烯醛中含有碳碳双键
C
向某溶液中滴加稀H2SO4溶液
产生有刺激性气味的气味
原溶液中一定含有SO32-
D
向某溶液中滴加几滴NaOH稀溶液,用湿润的红色石蕊试纸靠近试管口检验
试纸不变蓝
原溶液中一定不含有NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25 ℃时,下列说法正确的是( )
A.0.1 mol·L-1 (NH4)2SO4溶液中c(
)<c(
)
B.0.02 mol·L-1氨水和0.01 mol·L-1氨水中的c(OH-)之比是2∶1
C.向醋酸钠溶液中加入醋酸使溶液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
D.向0.1 mol·L-1 NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中c(Na+)=c(
)(不考虑酸的挥发与分解)
难度: 简单查看答案及解析
-
某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为
],酸液室通入
(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
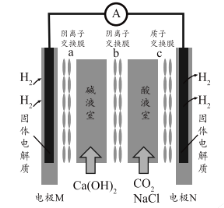
A.电子由N极经外电路流向M极
B.N电极区的电极反应式为
↑
C.在碱液室可以生成
D.放电一段时间后,酸液室溶液pH减小
难度: 中等查看答案及解析