-
化学与生活、技术、社会发展息息相关。下列说法不正确的是( )
A.食醋除水垢、油脂的皂化、煤的干馏都是化学变化
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.黑火药是我国古代的四大发明之一,配方为“一硫二硝三木炭”,其中的硝指的是硝酸
D.“绿水青山就是金山银山”,矿物燃料经过脱硫脱硝处理,可减少
、
的排放
难度: 简单查看答案及解析
-
化合物M的分子式为
,M既能使溴的四氯化碳溶液褪色又能与
溶液反应放出
,则M的可能结构(不考虑立体异构)共有( )
A.1种 B.2种 C.3种 D.4种
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素,其原子半径依X、Z、Y、W的顺序增大。已知Y的气态氢化物水溶液显碱性、Z是地壳中含量最高的元素,W的原子半径在同周期中最小(稀有气体除外)。下列说法正确的是( )
A.
的酸性强于
,所以W的非金属性比Y强
B.X、Y分别与Z按原子个数比2∶1形成的化合物都是弱电解质
C.由Y和Z元素形成的氧化物最多可有5种
D.由X、Y、Z元素组成的化合物均为共价化合物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将含有2NA个
的
溶液完全蒸干,得到
固体
B.常温下,
的
溶液中含有的
数目为0.2NA
C.
和足量S在加热条件下完全反应,转移的电子数为NA
D.常温下,将
铝片投入足量浓硫酸中,最终生成的
分子数为1.5NA
难度: 中等查看答案及解析
-
如图所示,金属(M)—空气电池具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为
。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
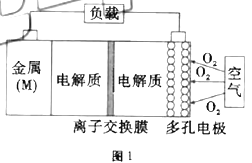
A.电池放电过程中正极发生还原反应
B.比较
、
、
三种金属—空气电池,
-空气电池的理论比能量最高
C.为防止负极区沉积
,宜采用中性电解质及阳离子交换膜
D.多孔电极可提高电极与电解质溶液的接触面积,提高反应速率
难度: 中等查看答案及解析
-
利用图中所示装置进行实验,不能得出相应现象的是( )
选项
溶液①
固体②
溶液③
实验现象
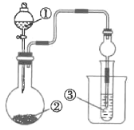
A
浓氨水
碱石灰
酚酞试液
酚酞试液变红
B
浓盐酸
溶液
产生淡黄色沉淀
C
浓硝酸
试管上方产生红棕色气体
D
稀硫酸
溶液
产生白色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
类比
的定义,对于稀溶液可以定义
,
,常温下,
溶液在不同
值下,测得
、
、
的变化如图所示,下列说法错误的是( )
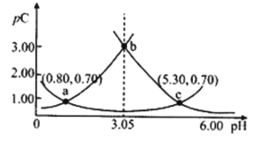
A.随着
的增大,左侧
增大的曲线是
的物质的量浓度的负对数
B.
的
溶液中,
C.
时,
D.
的电离平衡常数
难度: 中等查看答案及解析



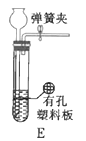
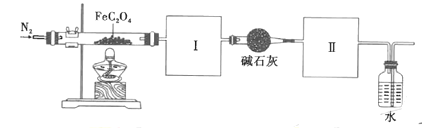
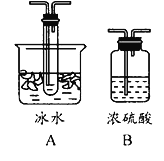

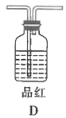
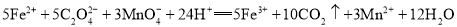 。
。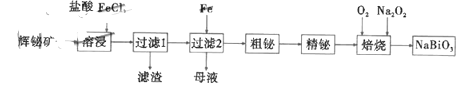
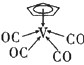 中,中心原子V的价电子与配体提供的电子数之和为18,配体
中,中心原子V的价电子与配体提供的电子数之和为18,配体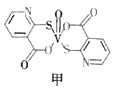
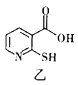
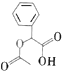 )的合成路线(部分产物和条件已省略):
)的合成路线(部分产物和条件已省略):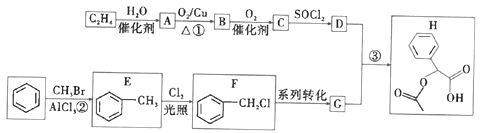
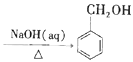 ________________________(无机试剂任选)。
________________________(无机试剂任选)。