-
化学在生活中有着广泛的应用,下列说法不正确的是
A.防哂霜能够防止强紫外线引起皮肤中蛋白质的变性
B.煤的脱硫、汽车尾气实行国Ⅵ标准排放都是为了提高空气质量
C.纳米级的铁粉能通过吸附作用除去水体中的Cu2+、Hg2+ 等重金属离子
D.利用肥皂水处理蚊虫叮咬,主要是利用肥皂水的弱碱性
难度: 简单查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1L 1 mol·L-1 的NaHCO3溶液中含有的离子数为3NA
B.22.4 L的CO2与过量Na2O2充分反应转移的电子数为NA
C.常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
难度: 简单查看答案及解析
-
根据下面实验或实验操作和现象,所得结论正确的是
实验或实验操作
现象
实验结论
A
用大理石和稀盐酸反应制取CO2气体,立即通入一定浓度的苯酚钠溶液中
出现白色沉淀
H2CO3的酸性比苯酚的酸性强
B
向某溶液先滴加硝酸酸化,再滴加BaC12溶液
有白色沉淀生成
原溶液中含有SO42-,SO32-,HSO3-中的一种或几种
C
向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制的氢氧化铜悬浊液并加热
无红色沉淀
蔗糖未水解
D
将浸透了石蜡油的石棉放置在试管底部,加入少量的碎瓷片,并加强热,将生成的气体通入酸性高锰酸钾溶液
溶液褪色
石蜡油分解产物中含有不饱和烃
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
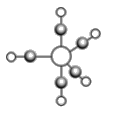
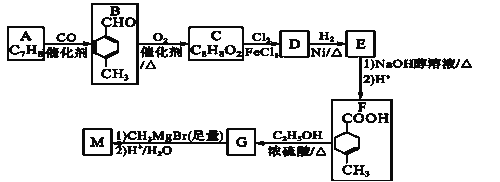
某有机物结构简式如图,下列对该物质的叙述中正确的是
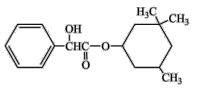
A.该有机物易溶于苯及水
B.该有机物苯环上的一氯代物共有4种
C.该有机物可以与溴的四氯化碳溶液发生加成反应使之褪色
D.1mol该有机物最多可与1mol NaOH发生反应
难度: 中等查看答案及解析
-
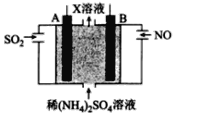
a、b、c、d为短周期元素,a的M电子层有1个电子,工业上采用液态空气分馏方法来生产供医疗急救用的b的单质,c与b同族,d与c形成的一种化合物可以溶解硫。下列有关说法正确的是
A.原子半径:a>b>c>d
B.元素非金属性的顺序为b>c>d
C.a与b形成的化合物只有离子键
D.最高价氧化物对应水化物的酸性:d>c
难度: 简单查看答案及解析
-
锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
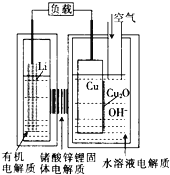
A.放电时,当电路中通过0.2mol电子的电量时,有0.2mol Li+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D.整个反应过程,空气中的O2起了催化剂的作用
难度: 中等查看答案及解析
-
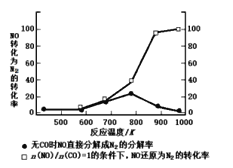
常温下,向20mL、浓度均为0.1mol·L-1的氢氧化钠溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是

A.a点溶液pH=11
B.曲线1中c与e之间某点溶液呈中性
C.c点溶液中:c(H+)=c(OH-)+c(N3H·H2O)
D.在a、b、c、d、e中,水电离程度最大的点是d
难度: 中等查看答案及解析