-
化学与生产、生活和环境密切相关。下列有关说法正确的是
A. 编织渔网的尼龙绳的主要成分是纤维素
B. 文房四宝中的砚台,用石材磨制的过程是化学变化
C. 丝绸的主要成分是蛋白质,它属于天然高分子化合物
D. 月饼中的油脂易被氧化,保存时常放入装有硅胶的透气袋
难度: 中等查看答案及解析
-
一氯代物的同分异构体有两种,二氯代物的同分异构体有四种的烷烃是( )
A.乙烷 B.丙烷 C.正丁烷 D.正戊烷
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数比为1∶1的具有漂白性的物质,工业上常用电解饱和YZ溶液来获得Z的单质及其他产品。下列说法正确的是
A.W和X、Y、Z均能形成18电子的分子
B.上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W)
C.X、Y之间形成的化合物可能同时含有离子键和非极性共价健
D.W、X、Z三种元素形成的化合物一定是弱酸
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.7.8 g 的Na2S和Na2O2的混合物中含有阴、阳离子总数为0.3NA
B.常温常压下,22.4 LCO2 中含有NA个CO2 分子
C.1.0 L 1.0mol·L-1的 NaClO水溶液中含有的氧原子数为NA
D.常温常压下,18 g 羟基(-17OH)中所含的中子数为8NA
难度: 简单查看答案及解析
-
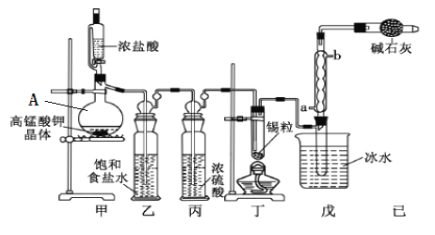
下列装置或操作能达到实验目的的是
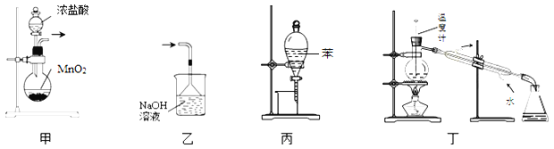
A.用装置甲制取氯气 B.用乙装置除去氯气中的HCl气体
C.用丙装置萃取溴水中的溴单质 D.用丁装置分离乙酸与乙醇
难度: 中等查看答案及解析
-
锂离子电池又称为“摇摆电池”,广泛使用于电动自行车等,其充放电过程就是锂离子的嵌入和脱嵌过程(习惯上正极用嵌入或脱嵌表示,负极用插入或脱插表示),即充放电过程就是锂离子在正、负极间往返运动而形成电流。其装置结构简图如图所示(电解液为溶有LiPF6的碳酸酯类溶剂,隔膜为仅有锂离子能通过的高分子膜),工作原理为C6Li+Li(1-x)MO2
LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
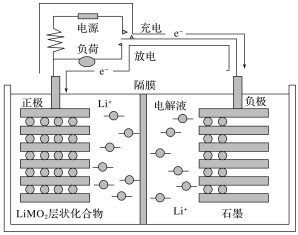
A.电池放电时,正极为石墨
B.锂离子电池的优点是质量小,电容量大,可重复多次使用
C.电池充电时阳极的反应为LiMO2-xe-=Li(1-x)MO2+xLi+
D.锂离子电池的电解液不能是水溶液,因为锂是活泼金属,能与水反应
难度: 中等查看答案及解析
-
常温下,向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是( )
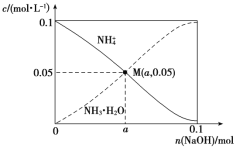
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05) mol
C.随着NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.1 mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
难度: 困难查看答案及解析
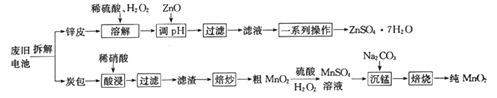
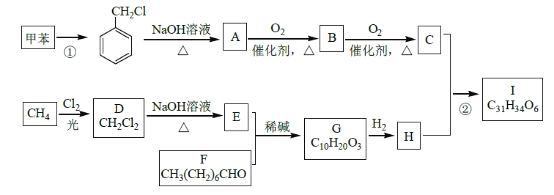
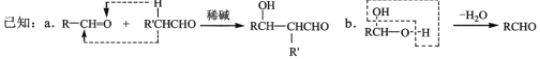
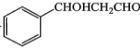 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:
的合成路线,其他无机试剂任选(合成路线常用的表示方式为: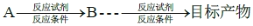 )____________。
)____________。