-
中国传统文化对人类文明贡献巨大,书中充分记载了古代化学研究成果。下列关于古代化学的应用和记载,对其说明不合理的是( )
A.《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用了KNO3的氧化性
B.杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
C.我国古代人民常用明矾除去铜器上的铜锈[Cu2(OH)2CO3]
D.蔡伦利用树皮、碎布(麻布)、麻头等为原料精制出优质纸张,由他监制的纸被称为“蔡侯纸”。“蔡侯纸”的制作工艺中充分应用了化学工艺
难度: 简单查看答案及解析
-
化学与生产和生活密切相关,下列分析错误的是
A.用氯化钙作钢箱梁大桥融雪剂会加速钢铁腐蚀
B.对燃煤进行脱硫处理有利于减少酸雨的产生
C.明矾水解生成的胶体可吸附水中悬浮颗粒物
D.芳香族化合物有香味,均可以用作食品香味剂
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.7g14C中,含有3NA个中子
B.25℃时,pH=4的CH3COOH溶液中H+的数目为10-4NA
C.3.2gCu与足量浓硝酸反应,生成的气体在标准状况下的体积为22.4L
D.标准状况下,5.6L丙烷中含有共价键的数目为2.5NA
难度: 中等查看答案及解析
-
稠环芳烃如萘
、菲
、芘
等均为重要的有机化工原料。下列说法正确的是
A. 萘、菲、芘互为同系物 B. 萘、菲、芘的一氯代物分别为2、5、3种
C. 萘、菲、芘中只有萘能溶于水 D. 萘、菲、芘的所有原子不可能处于同一平面
难度: 简单查看答案及解析
-
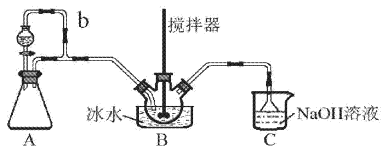
实验室利用乙醇催化氧化法制取并提纯乙醛的实验过程中,下列装置未涉及的是( )
A.
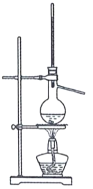 B.
B.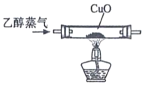 C.
C. D.
D.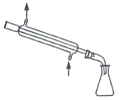
难度: 中等查看答案及解析
-
下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项
实验操作
实验目的或结论
A
室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解且有无色无味气体产生
验证Ksp(BaSO4)<Ksp(BaCO3)
B
将混有Ca(OH)2杂质的Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。
除去Mg(OH)2样品中Ca(OH)2杂质
C
向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色
NO3-被氧化为NH3
D
室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5
HSO3-结合H+的能力比SO32-的强
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
室温下,将1L0.3mol⋅ L−1HA溶液与0.1molNaOH固体混合,使之充分反应得到溶液(a)。然后向该溶液中通入HCl或加入NaOH固体(忽略体积和温度变化),溶液pH随通(加)入物质的量的变化如图。下列叙述错误的是
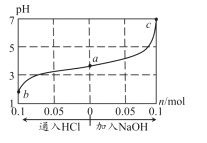
A.HA是一种弱酸
B.向a点对应溶液中通入HCl,充分反应后,c(H+)/c(HA)增大
C.b点对应溶液中:c(Na+)=c(Cl-)>c(HA)>c(H+)>c(OH-)
D.c点对应溶液中:c(Na+)=c(A-)
难度: 中等查看答案及解析

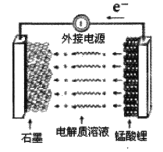

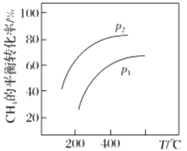
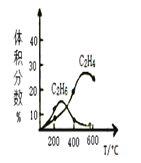
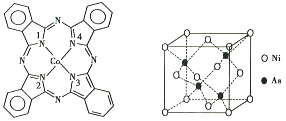
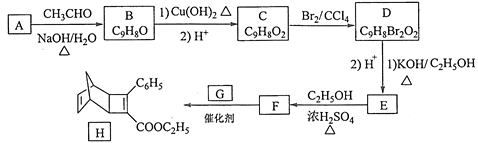
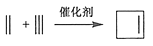 。
。