-
废电池投入的垃圾桶上应贴有的垃圾分类标志是( )
A.有害垃圾
 B.可回收物
B.可回收物 
C.餐厨垃圾
 D.其它垃圾
D.其它垃圾 
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数的值。下列说法正确的是 ( )
A.0.5 mol 雄黄(As4S4),结构为
,含有NA个 S—S键
B.将 1 mol NH4NO3 溶于适量稀氨水中,所得溶液呈中性,则溶液中 NH4+的数目为 NA
C.107 g Fe(OH)3 分散质的胶体中胶体粒子的数目为NA
D.高温下,16.8 g Fe与足量水蒸气完全反应,转移的电子数为 0.6NA
难度: 中等查看答案及解析
-
N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用
、、
分别表示N2、H2、NH3,下列说法正确的是( )

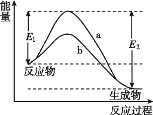
A.使用催化剂时,合成氨的反应放出的热量减少
B.在该过程中,N2、H2 断键形成 N 原子和 H 原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
难度: 中等查看答案及解析
-
下列实验中,依据操作及现象,得出的结论正确的是( )
实验操作
现象
结论
A
取少量Na2O2 粉末,向其中滴加过量的稀盐酸
产生无色气体
Na2O2样品已变质
B
向 Ca(ClO)2 溶液中通入 SO2 气体
产生白色沉淀
H2SO3的酸性强于 HClO
C
将 Fe(NO3)2样品溶于稀 H2SO4后,滴加KSCN 溶液
溶液显红色
Fe(NO3)2样品已氧化变质
D
向某溶液中先加入几滴 KSCN溶液,无明显现象,再滴加H2O2溶液
溶液变为浅红色
原溶液中有含Fe2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
实验室模拟工业制备高纯铁。用惰性电极电解FeSO4溶液制备高纯铁的原理如图所示:
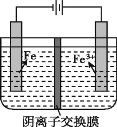
下列说法不正确的是( )
A.阴极主要发生反应:Fe2++2e-=Fe
B.向阳极附近滴加 KSCN 溶液,溶液变红
C.电解一段时间后,阴极附近pH减小
D.电解法制备高纯铁总反应:3Fe2+
Fe+2Fe3+
难度: 中等查看答案及解析
-
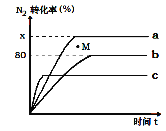
已知 2NO(g)+O2(g)⇌2NO2(g) H<0,若该反应在绝热、恒容的密闭体系中进行,则下列示意图能说明在t1时刻达到平衡状态的是 ( )
a.
b.
 c.
c. 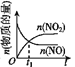 d.
d. 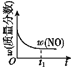
A.ab B.bc C.bd D.cd
难度: 困难查看答案及解析
-
25℃时,用0.10 mol/L的氨水滴定10.00mL0.05mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中
的关系如图所示。下列说法正确的是( )
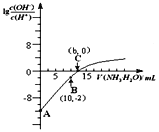
A.H2A的电离方程式为H2A
H++HA -
B.B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C.C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D.25℃时,该氨水的电离平衡常数为
难度: 困难查看答案及解析
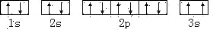 该同学所画的电子排布图违背了____
该同学所画的电子排布图违背了____
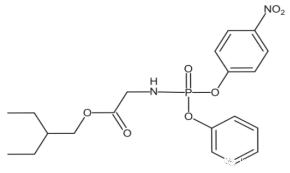
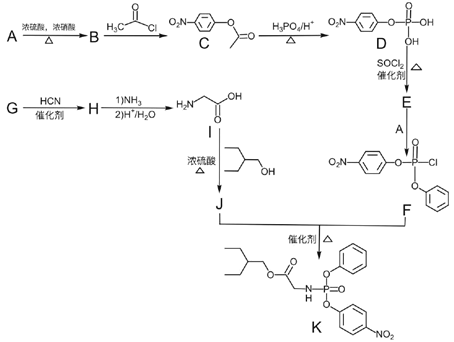
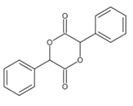 的合成路线__________ (无机试剂任选)。
的合成路线__________ (无机试剂任选)。