-
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X,Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
难度: 中等查看答案及解析
-
2008年2月14日中央电视台报道,美国探测发现,在土卫六上的碳氢化合物的储量是地球上的几百倍。对此,有关说法不正确的是( )
A.碳氢化合物就是我们通常所说的烃
B.这一发现可以为我们提供足够的化石燃料,从而减少开发新能源的投资
C.从石油中可以获得重要的有机化工原料—乙烯
D.碳氢化合物中氢的质量分数越高,当其质量相等时完全燃烧消耗的O2越多
难度: 简单查看答案及解析
-
下列物质中不能通过置换反应生成的是( )
A.F2 B.CO C.C D.Fe3O4
难度: 中等查看答案及解析
-
2008年奥运会即将在北京举行,下列有关说法不正确的是 ( )
A.祥云火炬的燃料是丙烷,其分子式为
B.奥运会将严查运动员服用兴奋剂,有—种兴奋剂的结构简式为
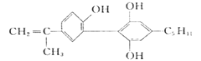 ,其分子式为C20H24O3
,其分子式为C20H24O3C.奥运会所使用的锂电池为高能电池,其显著特点是提供相同电量时所需的金属正极质量最小
D.“金镶玉”奖牌中玉的化学成分主要是含水钙镁硅酸盐,如
,可表示为
·
·
·
难度: 中等查看答案及解析
-
磁性氧化铁与稀HNO3发生反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O。下列判断合理的是 ( )
A.Fe(NO3)x中的x为2
B.反应中每生成0.2mol还原产物,就有0.6mol电子转移
C.稀HNO3在反应中只作氧化剂
D.磁性氧化铁中的所有铁元素全部被氧化
难度: 中等查看答案及解析
-
提纯下列物质(括号内物质为杂质)。实验操作合理的是( )
A.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
B.苯(苯酚):加入足量浓溴水,充分振荡.静置后分液
C.
:通人盛有
溶液的洗气瓶
D.
[
]:放入水中调成浆状,加入足量
溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
难度: 中等查看答案及解析
-
如图中,两电极上发生的电极反应如下:a极:
↑,b极:
-2
=
。则以下说法不正确的是( )

A.该装置可能是电解池
B.该装置中电解质溶液pH可能等于7
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
难度: 中等查看答案及解析
-
有A、B两种短周期元素,其原子电子层数均为n,原子核内质子数依次为
十3、2
-4。已知它们都能与氧气直接化合生成最高价氧化物。下列有关说法正确的是 ( )
A.A能形成化学式为
的酸
B.B的单质能与许多酸、碱溶液反应
C.B的氧化物高温下能与
反应
D.它们的最高价氧化物均是原子晶体,熔点都很高
难度: 中等查看答案及解析
-
如图,在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器。在Ⅰ、Ⅱ中分别加入2 mol A和2 mol B,起始时容器体积均为V L,发生如下反应并达到化学平衡状态: 2A十B→xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是( )
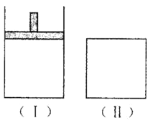
A.x的值为2
B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同
D.平衡时,Ⅰ容器的体积小于V L
难度: 中等查看答案及解析
-
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-====4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2====2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
难度: 中等查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是( )
A.
B.
C.
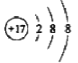 D.
D.
难度: 简单查看答案及解析
-
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2、Na2CO3
C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3
难度: 中等查看答案及解析
-
下列叙述正确的是
A.金属与盐溶液的反应都是置换反应
B.阴离子都只有还原性
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.分子晶体中都存在范德瓦斯力,可能不存在共价键
难度: 中等查看答案及解析
-
下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4 ③HCl NaAlO2 ④Ca(OH)2 Na2CO3 BaCl2
A.①②③ B.②③ C.①③④ D.①②④
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中
增大
难度: 困难查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
难度: 简单查看答案及解析
-
2008年6月1日起,所有超市、商场、集贸市场等商品零售场所将实行塑料购物袋有偿使用。下列说法正确的是
A.控制塑料购物袋的使用主要是为了节约成本
B.使用可降解塑料袋有利于减少“白色污染”
C.聚氯乙烯塑料袋可用来长时间存放食品
D.塑料购物袋具有热固性,不能回收利用
难度: 中等查看答案及解析