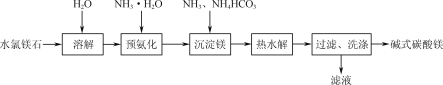
-
干冰常用作制冷剂,其化学式为( )
A.CO2 B.H2O
C.CH4 D.C
难度: 简单查看答案及解析
-
小明化验单上“葡萄糖”一项结果为4.94×10-3mol·L-1。这里的“4.94×10-3mol·L-1”表示葡萄糖的( )
A.体积 B.物质的量
C.摩尔质量 D.物质的量浓度
难度: 简单查看答案及解析
-
下列变化属于化学变化的是( )
A.磨铁成针 B.酿酒成醋
C.氧气液化 D.滴水成冰
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能产生丁达尔效应的是( )
A.稀硝酸
B.Na2SO4溶液
C.Fe(OH)3胶体
D.KNO3溶液
难度: 简单查看答案及解析
-
氯化钾溶液在火焰上灼烧时,透过蓝色钴玻璃观察到火焰的颜色为( )
A.紫色 B.红色
C.蓝色 D.黄色
难度: 简单查看答案及解析
-
研究化学反应常用
作为示踪原子。该原子的中子数是( )
A.8 B.10 C.16 D.18
难度: 简单查看答案及解析
-
下列化学用语表示正确的是( )
A.乙醇的结构式:C2H6O
B.氯化氢的电子式:H+[
]-
C.Mg原子的结构示意图:
D.硫酸的电离方程式:H2SO4=H2++SO42-
难度: 简单查看答案及解析
-
石英(SiO2)系列光纤已广泛应用于有线电视和通信系统。SiO2属于( )
A.盐 B.酸
C.单质 D.氧化物
难度: 简单查看答案及解析
-
下列物质的俗名与化学式相对应的是( )
A.熟石灰——CaO B.苏打——Na2CO3
C.铁红——Fe3O4 D.烧碱——Ca(OH)2
难度: 简单查看答案及解析
-
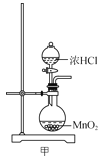
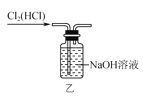
下列关于Cl2的制备、净化、收集及尾气处理的装置和原理能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙除氯化氢
C.用装置丙收集氯气
D.用装置丁吸收尾气

难度: 简单查看答案及解析
-
在含有大量Na+、OH-、NO3-的溶液中,还可能大量存在的离子是( )
A.CO32- B.Mg2+ C.NH4+ D.Al3+
难度: 简单查看答案及解析
-
下列物质含有离子键的是( )
A.N2 B.CO2 C.CaCl2 D.NH3
难度: 简单查看答案及解析
-
下列物质不属于高分子的是( )
A.淀粉 B.葡萄糖
C.蛋白质 D.聚氯乙烯
难度: 简单查看答案及解析
-
下列气体排放到空气中,会导致酸雨的是( )
A.H2 B.CO C.NO2 D.CO2
难度: 简单查看答案及解析
-
下列物质互为同分异构体的是( )
A.1H和2H B.O2和O3
C.CH4和C2H6 D.CH3CH2OH和CH3OCH3
难度: 简单查看答案及解析
-
下列关于乙烯的说法正确的是( )
A.能使溴水褪色 B.易溶于水
C.结构简式为CH2CH2 D.是天然气的主要成分
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.Cl2与水反应:Cl2+H2O=2H++Cl-+ClO-
B.H2SO4溶液与氨水反应:H++OH-=H2O
C.CuO与稀盐酸反应:CuO+2H+=Cu2++H2O
D.Al粉与NaOH溶液反应:Al+2OH-=AlO2-+H2↑
难度: 简单查看答案及解析
-
某原电池装置如图所示。该电池工作时,下列说法正确的是( )

A.铜片为负极
B.锌片发生氧化反应
C.该装置能将电能转化成化学能
D.电子由铜片通过外电路流向锌片
难度: 简单查看答案及解析
-
下列有机反应属于加成反应的是( )
A.CH2=CH2+HBr
CH3CH2Br
B.CH3CH3+Cl2
CH3CH2Cl+HCl
C.2CH3CH2OH+O2
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
难度: 简单查看答案及解析
-
下列实验方案能达到目的的是( )
A.用浓硫酸干燥NH3
B.用乙醇萃取碘水中的碘单质
C.用加热的方法除去NaCl固体中的少量NaHCO3
D.用KSCN溶液鉴别Fe2(SO4)3溶液和FeCl2溶液
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子最外层有2个电子,Z单质晶体是一种重要的半导体材料,W与X位于同一主族。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是共价化合物
C.W的简单气态氢化物的热稳定性比X的强
D.W的最高价氧化物对应水化物的酸性比Z的强
难度: 简单查看答案及解析
-
在探究SO2的性质实验中,下列根据实验现象得出结论不正确的是( )
A.向溴水中通入SO2,溶液褪色,说明SO2具有漂白性
B.SO2的水溶液能使紫色石蕊溶液变红,说明它能与水反应生成H2SO3
C.将足量SO2的通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有还原性
D.向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
难度: 简单查看答案及解析