-
以下关于化学实验中“先与后”的说法中正确的是
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2
⑥碱液流到桌子上,先加稀醋酸溶液中和,后用水洗
A. ①②③⑤⑥ B. ①②④⑤ C. ①②③④⑤ D. 全部
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A. 与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH−
B. 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3-
C. 漂白粉溶液中:K+、Na+、I−、CO32-
D. FeCl3溶液中:K+、Na+、SO42-、SCN−
难度: 简单查看答案及解析
-
下列物质间的每步转化只需通过一步反应就能实现的是( )
A.Fe→Fe2O3→Fe(OH)3→FeCl3 B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→Na2O2→Na2CO3→NaOH D.Si→SiO2→H2SiO3→Na2SiO3
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是
A.往Na2SiO3溶液中加入盐酸:2Na++SiO32-+2H+=H2SiO3↓+2Na+
B.氯气与烧碱溶液反应:Cl2+2OH−=Cl−+ClO−+H2O
C.向偏铝酸钠溶液中通入过量CO2气体:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
难度: 简单查看答案及解析
-
关于某无色溶液中所含离子或物质的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,再加入稀盐酸沉淀不溶解,可确定有Cl-存在。
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在。
C.某棕黄色溶液,加入四氯化碳充分振荡静置后下层变为紫红色,则原液有I2存在。
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
难度: 简单查看答案及解析
-
目前我国许多城市定期公布空气质量报告,在空气质量报告中,一般不涉及( )
A.SO2 B.NO2 C.CO2 D.可吸入颗粒物
难度: 简单查看答案及解析
-
将15.6 g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A.标准状况下,反应过程中得到6.72 L的气体
B.最终得到的溶液中c(Na+)=c(Cl−)+c(OH−)
C.最终得到7.8 g的沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L−1
难度: 困难查看答案及解析
-
草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
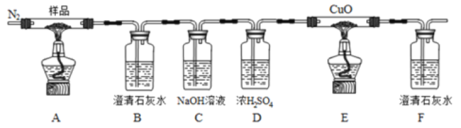
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
难度: 简单查看答案及解析
-
下列有关物质的分类正确的是
A.混合物:空气、矿泉水、水银
B.酸性氧化物:、CO2、SO2、CO
C.盐:醋酸钠、氯化铵、纯碱
D.弱电解质:CH3COOH、H2O、NH3
难度: 简单查看答案及解析
-
用NaOH固体配制1.0 mol·L-1的NaOH溶液220 mL,下列说法正确的是( )
A. 首先称取NaOH固体8.8 g
B. 定容时仰视刻度线会使所配制的溶液浓度偏高
C. 定容后将溶液均匀,静置时发现液面低于刻度线,于是又加少量水至刻度线
D. 容量瓶中原有少量蒸馏水没有影响
难度: 中等查看答案及解析
-
在t℃时,将 a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,质量分数为ω ,其中含NH4+的物质的量为 b moL。下列叙述中正确的是
A.溶质的质量分数为ω=
100%
B.溶质的物质的量浓度 c
mol L1
C.溶质一水合氨是强电解质
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
难度: 中等查看答案及解析
-
已知反应:①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2 ═Br2 +2KClO3,下列说法正确的是
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KClO3>KBrO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为 5:1
D.③中 1mol 还原剂反应则氧化剂得到电子的物质的量为 2mol
难度: 简单查看答案及解析
-
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中获取MgCl2
C.第④步电解得到,镁的方程式为MgCl2(熔融)
Mg+Cl2↑
D.提取镁的过程涉及化合、分解、置换反应
难度: 中等查看答案及解析
-
列关于氯气的实验装置能达到实验目的的是

①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A. ①② B. ①③ C. ②③ D. ①④
难度: 困难查看答案及解析
-
实验室保存下列物质的方法中,不正确的是
A.少量金属钠保存在煤油里
B.HF溶液保存在玻璃试剂瓶中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.氯水应装在棕色瓶中密封避光保存
难度: 中等查看答案及解析
-
100mL Al2(SO4)3溶液中含Al3+2.7g,取该溶液的10 mL并加水稀释到100 mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.0.25 mol·L-1 B.0.15 mol·L-1
C.0.175 mol·L-1 D.0.125mol·L-1
难度: 中等查看答案及解析
-
过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后排出气体,残留的物质应是
A.Na2O和Na2O2 B.Na2O2和Na2CO3 C.Na2CO3 D.Na2O
难度: 中等查看答案及解析
-
向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
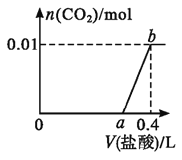
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
难度: 困难查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列说法中,不正确的是
A.x=4
B.每生成 1mol Fe3O4,反应转移的电子总数为 3mol
C.1mol Fe2+被氧化时,被 Fe2+还原的 O2的物质的量为 0.25mol
D.可以通过丁达尔效应判断有无 Fe3O4纳米颗粒生成
难度: 简单查看答案及解析
-
将12.8g两种金属的混合物投入足量的盐酸中,反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是( )
A.钙和锌 B.镁和铜 C.铝和镁 D.钠和铁
难度: 中等查看答案及解析