-
2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是( )
A.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.用聚氯乙烯代替木材生产快餐盒,以减少木材的使用
C.碳纳米管表面积大,可用作新型储氢材料
D.铜导线和铝导线缠绕连接处暴露在雨水中比在干燥环境中更快断裂的主要原因是发生了电化学腐蚀
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B.7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C.18g固态水(冰)中含有的氢键的数目为2NA
D.25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
难度: 中等查看答案及解析
-
下列各选项有机物同分异构体的数目,与分子式为C5H12O且含有两个甲基的醇的有机物数目相同的是(不含立体异构):
A.分子式为CH2BrCl 的卤代烃
B.分子式为C4H8O2的酯
C.
的一溴代物
D.立方烷(
)的二氯代物
难度: 中等查看答案及解析
-
A、B、C、D是中学化学中常见的四种物质,且A、B、C中含有同一种元素,其转化关系如图所示。下列说法正确的是( )

A.若B为一种两性氢氧化物,则D可能是强酸,也可能是强碱
B.若A为固态非金属单质,D为O2,则A可以为单质硫
C.若A为强碱,D为CO2,则B的溶解度一定大于C的溶解度
D.若A为18电子气态氢化物,D为O2,则A只能是C2H6
难度: 中等查看答案及解析
-
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )
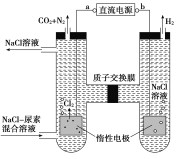
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
难度: 中等查看答案及解析
-
用下列实验方案不能达到实验目的的是:
A.Cu和稀硝酸制取NO
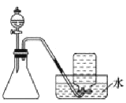
B.检验乙炔的还原性
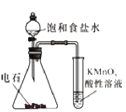
C.实验室制取溴苯
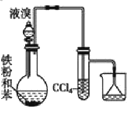
D.实验室分离CO和CO2
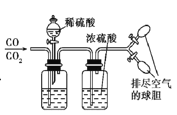
难度: 中等查看答案及解析
-
常温下,用0.10mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图(忽略体积变化)。下列说法正确的是( )
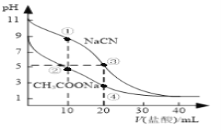
A.溶液中阳离子的物质的量浓度之和:点②等于点③
B.点①所示溶液中:c(CN-)+c(HCN)﹤2c(Cl-)
C.点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)>c(CH3COOH)
D.点④所示溶液中:c(Na+)+c(CH3COOH)+c(H+)>0.10mol·L-1
难度: 中等查看答案及解析
 ,该电子排布图违背了________。
,该电子排布图违背了________。

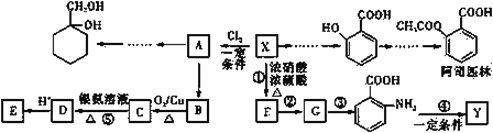
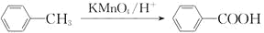
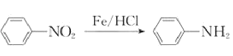 (苯胺,易被氧化)
(苯胺,易被氧化)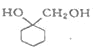 的合成路线流程图(其它试剂任选)_________________。
的合成路线流程图(其它试剂任选)_________________。