-
相同条件下,ag的A气体与bg的B气体占有相同体积。下列叙述错误的是 ( )
A. a∶b等于A与B的相对分子质量之比
B. a∶b等于等质量的A与B的分子数之比
C. a∶b等于同温同压下A与B的密度之比
D. b∶a等于同温同体积等质量的A与B的压强比
难度: 中等查看答案及解析
-
下列实验操作错误的是( )
A. 分液漏斗使用前需要先检查是否漏液
B. 实验中剩余的钠不能再放回原试剂瓶
C. 做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D. 蒸馏烧瓶加热时需要垫石棉网
难度: 中等查看答案及解析
-
(CN)2、(SCN)2的化学性质与卤素单质很相似,化学上称之为拟卤素。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。下列有关反应的叙述中不正确的是
A. Cl2通入NaCN溶液中有(CN)2生成
B. (CN)2在碱液中能生成CN-和CNO-
C. NaBr和KSCN的混合液中加入足量的(CN)2,有Br2和(SCN)2生成
D. 在化学反应中,(CN)2、(SCN)2可作氧化剂
难度: 简单查看答案及解析
-
某溶液中加入稀硫酸,能产生使澄清石灰水变浑浊的无色无味的气体;再加入氯化钡溶液,能产生白色沉淀。关于该溶液的下列结论中正确的是( )
A. 一定含有碳酸根离子 B. 一定含有碳酸氢根离子
C. 一定含有硫酸根离子 D. 可能含有硫酸根离子
难度: 简单查看答案及解析
-
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
难度: 简单查看答案及解析
-
下列变化属于氧化反应的是(
A.CO2→CO B.Cl﹣→Cl2 C.Fe3+→Fe2+ D.CO32—→CO2
难度: 简单查看答案及解析
-
下列描述的一定是金属单质的是( )
A.易失去电子的物质 B.能与酸反应的物质
C.其原子的最外层只有1个电子 D.其原子的核内有11个质子
难度: 中等查看答案及解析
-
下列关于氮气的说法中错误的是( )
A. 氮气在通常情况下不燃烧,也不支持燃烧,不能供呼吸
B. 液氮可用于医学和高科技领域,制造低温环境
C. 高温或通电的条件下,氮气能与氧气化合生成一氧化氮
D. 高温高压催化剂条件下与氢气反应时,氮气作还原剂
难度: 中等查看答案及解析
-
为了确定某物质是否变质,所选试剂(括号内物质)错误的是
A. Na2SO3是否被氧化(BaCl2) B. FeCl2是否被氧化(KSCN)
C. KI是否被氧化(淀粉溶液) D. 氯水是否失效(pH试纸)
难度: 中等查看答案及解析
-
下列物质中含有的电子数最多的是
A.27 g H2O B.51 g H2O2 C.34 g OH- D.19 g H3O+
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.标准状况下,22.4 L水中含有6.02×1023个水分子
B.32 g氧气所含的原子数目为2×6.02×1023
C.常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L
D.1 mol CaCl2溶于水配成1 L溶液,所得溶液中Cl﹣的物质的量浓度为1 mol·L-1
难度: 中等查看答案及解析
-
下列关于水泥和普通玻璃工业生产的叙述正确的是
①产品都是硅酸盐 ②反应条件都是高温 ③都用含有硅的物质作原料 ④反应原理都是一系列复杂的物理化学变化
A.①③ B.①②③ C.①③④ D.①②③④
难度: 简单查看答案及解析
-
下列关于铁与水蒸气反应的叙述不正确的是( )
A.是氧化还原反应 B.铁是还原剂
C.需在高温条件下进行 D.产物是氧化铁和氢气
难度: 中等查看答案及解析
-
能与Fe3+反应且能证明Fe3+具有氧化性的物质是( )
A. 氢氧化钠 B. 硫氰化钾 C. 氯化亚铁 D. 铁
难度: 简单查看答案及解析
-
松花皮蛋是夏季餐桌上的一道美食,其制作的原料有纯碱、食盐、生石灰、草木灰(内合碳酸钾)、开水以及糠、稻壳等辅料,配料之间首先是生石灰与水反应生成熟石灰,试推断另外最有可能发生的化学反应是( )
A.化合反应
B.分解反应
C.复分解反应
D.置换反应
难度: 简单查看答案及解析
-
已知:2Fe2++Cl2===2Fe3++2Cl﹣;HClO+HCl===Cl2+H2O;2Fe3++Cu===2Fe2++Cu2+;Fe+Cu2+===Fe2++Cu,下列各组物质氧化性强弱顺序正确的是( )
A.Fe3+>HClO>Cl2>Fe2+>Cu2+
B.HClO>Cl2>Fe3+>Cu2+>Fe2+
C.Cl2>HClO>Fe3+>Cu2+>Fe2+
D.HClO>Fe3+>Cl2>Cu2+>Fe2+
难度: 简单查看答案及解析
-
下列反应中关于“H2O”的说法错误的是( )
A.2F2+2H2O=4HF+O2反应中,水作还原剂,失电子
B.2Na+2H2O=2NaOH+H2↑反应中,水被氧化
C.CH4+2O2=CO2+2H2O反应中,H2O是还原产物
D.Na2O+H2O=2Na++2OH﹣反应中,水既不是氧化剂也不是还原剂
难度: 简单查看答案及解析
-
把一小块钠投入盛有煤油和水的烧杯中,可以观察到的现象是( )
A.钠浮在烧杯中的液面上 B.钠沉在烧杯的底部
C.钠会在水和煤油的交界面上下浮动,直到反应结束 D.煤油会燃烧起来,产生很浓的黑烟
难度: 简单查看答案及解析
-
下列关于化学与生产、生活的认识错误的是
A.CO2、SO2、N2等均是造成温室效应的气体
B.节能减排符合低碳经济的要求
C.使用清洁能源是防止酸雨发生的重要措施之一
D.大量焚烧田间秸秆会污染空气
难度: 简单查看答案及解析
-
下列实验目的能够实现的是( )
A. 用托盘天平称取3.23 g NaCl固体 B. 用50 mL量筒量取30.12 mL水
C. 向小试管中加入100 mL稀盐酸 D. 用胶头滴管取约1 mL溶液
难度: 简单查看答案及解析
-
在1 L 1 mol·L-1的氨水中,下列说法正确的是( )
A.含1 mol NH3·H2O B.含1 mol
和OH-
C.含
和NH3·H2O的和为1 mol D.含NH3、NH3·H2O、
之和为1 mol
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用过滤的方法可分离碳酸钙和氯化钠溶液的混合物
B.为加快过滤,使用玻璃棒搅动漏斗里的液体
C.蒸发食盐水时,开始析出晶体后用玻璃棒搅拌
D.为加快蒸发的速度,可以加热至水全部蒸干得到晶体
难度: 简单查看答案及解析
-
下列溶液分别与碳酸氢钠溶液混合后不能发生反应的是( )
A.氢氧化钙溶液 B.氢氧化钡溶液
C.氢氧化钠溶液 D.氯化钙溶液
难度: 简单查看答案及解析
-
已知H+可以写成H3O+,从某些性质看,NH3和H2O,
和H3O+,OH-和
,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①2Na+2NH3=2NaNH2+H2↑
②CaO+2NH4Cl=CaCl2+2NH3↑+H2O
③3Mg(NH2)2=Mg3N2+4NH3↑
④NH4Cl+NaNH2=NaCl+2NH3↑
A.① B.②④ C.全部 D.①②④
难度: 中等查看答案及解析
-
实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色溶液,且在溶液中四种离子的物质的量浓度均为1 mol·L-1。下列四个离子组能达到要求的是( )
A.Na+、K+、
、Cl- B.Cu2+、K+、
、
C.H+、K+、
、Cl- D.Mg2+、Na+、Cl-、
难度: 中等查看答案及解析
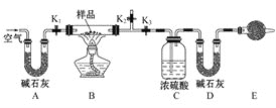
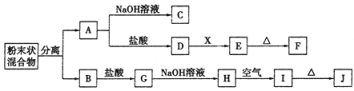
 b.
b.  d.
d.