-
下列检验方法,利用该气体的氧化性的是
A. Cl2使湿润的淀粉碘化钾试纸变蓝
B. SO2使品红溶液褪色
C. NH3使湿润的红色石蕊试纸变蓝
D. NO遇到空气变为红棕色
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析:
①氯化钠固体和氯化氢气体都不导电是因为二者中都不存在离子
②碳酸钠、氢氧化钡、氯化铵都属于离子化合物
③醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物
④氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质
⑤碳酸钠晶体在空气中风化是化学变化,硫酸铜晶体溶于水是物理变化
⑥用玻璃棒蘸取溶液进行焰色反应实验,火焰呈黄色说明溶液中含有Na+
⑦用Ba(NO3)2溶液、品红试液都可以区分CO2和SO2这两种气体
上述说法正确的是
A.①④⑤⑥ B.②③⑥⑦ C.②③④⑤ D.②④⑤⑦
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载
化学知识
A
《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”
铁的合金硬度比纯铁的大,熔点比纯铁的高
B
《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛”
强水为氢氟酸
C
《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴
硫指的是硫黄.硝指的是硝酸钾
D
《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之
糖白的过程发生了化学变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关叙述正确的是
①氧化镁:可用作耐火材料;②二氧化硅:制造计算机芯片;③水玻璃:可作木材防火剂;④铝热反应既可 用于焊接钢轨,也可用于工业上冶炼铁;⑤水煤气属于清洁能源;⑥浓硫酸:可用于干燥Cl2、SO2、H2S等气体
A.①③⑤ B.②⑤⑥ C.②③④⑤ D.①③⑥
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值,下列说法正确的是
A.12gNaHSO4晶体中SO42-数目为0.1NA
B.2.0gD2O中含有的中子数为NA
C.2.24LCl2与足量Na2SO3溶液反应时转移的电子数为0.2NA
D.标准状况下,4.48 LHF所含原子数目为0.4NA
难度: 中等查看答案及解析
-
著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A.铈(Ce)元素在自然界中主要以化合态形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+ = Ce3++Fe3+
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素
难度: 中等查看答案及解析
-
Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分。铜的冶炼过程通常发生反应:Cu2S+2Cu2O=6Cu+SO2↑,下列有关说法正确的是( )
A.该反应中有三种元素的化合价发生了变化
B.每生成0.1molCu,转移0.2mol电子
C.Cu2S在反应中既是氧化剂又是还原剂
D.Cu既是氧化产物又是还原产物
难度: 中等查看答案及解析
-
下列实验操作规范且能达到相应实验目的的是( )
选项
实验目的
实验操作
A
配制100g4%的NaOH溶液
称取4.0gNaOH放在烧杯中,再加入96.0mL水,搅拌均匀
B
证明铜与浓硫酸反应生成硫酸铜
向反应后并冷却的试管中加入适量的水,溶液变蓝
C
证明Ksp(BaSO4)<Ksp(BaCO3)
向BaCO3悬浊液中加入饱和Na2SO4溶液
D
检验Al和Fe2O3反应后固体中是否含Fe2O3
取样,溶于足量稀硫酸,滴加KSCN溶液不变红,说明不含Fe2O3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为( )
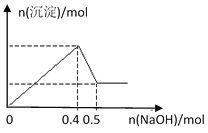
A.1:3 B.1:6 C.2:3 D.3:2
难度: 中等查看答案及解析
-
在给定条件下,下列所示的物质间的转化均能实现的是
A.SiO2
Na2SiO3(aq)
H2SiO3
B.MgCl2·6H2O
MgCl2
Mg
C.SO2
CaSO3
CaSO4
D.Fe
Fe2O3
FeCl3(aq)
难度: 中等查看答案及解析
-
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH−外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为( )
A. 2:5 B. 3:1 C. 5:2 D. 1:1
难度: 中等查看答案及解析
-
有关硫及其化合物说法正确的是
A.有浓硫酸参与的反应都是氧化还原反应
B.硫在足量空气中燃烧生成大量SO3
C.SO2能使酸性高锰酸钾溶液褪色,体现了漂白性
D.二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加
难度: 简单查看答案及解析
-
向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A.Cu2+是H2O2分解反应的催化剂
B.H2O2既表现氧化性又表现还原性
C.Cu2+将H2O2还原为O2
D.发生了反应Cu2O + H2O2 + 4H+ == 2Cu2+ + 3H2O
难度: 中等查看答案及解析
-
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量的关系如图所示。
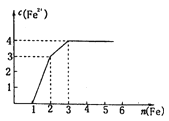
溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:1 B.1:3:1 C.1:1:4 D.3:3:8
难度: 中等查看答案及解析
-
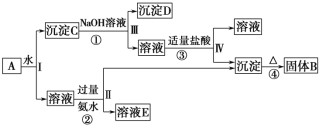
A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是

A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
难度: 中等查看答案及解析
-
下列实验现象与对应结论均正确的是( )
选项
操作
现象
结论
A
常温下将铁片放入浓硫酸中
剧烈反应生成有刺激性气味气体
常温下铁易与浓硫酸发生反应
B
Al2(SO4)3溶液中滴加过量稀氨水
先生成白色沉淀,随后又溶解
Al(OH)3能溶于氨水
C
向某溶液中滴加KSCN溶液
溶液变为红色
该溶液中含有Fe3+
D
将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰
黑色的铜丝变红
CuO被内焰中的乙醇蒸气氧化
A. A B. B C. C D. D
难度: 中等查看答案及解析