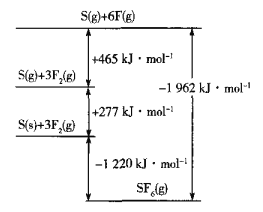
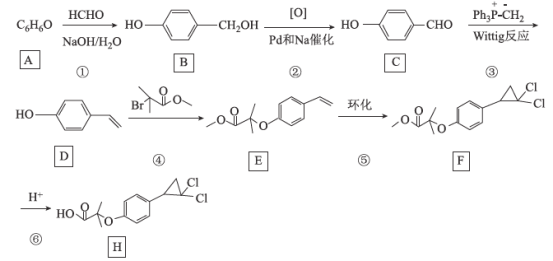
-
主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20。Q的简单氢化物和其最高价含氧酸可以化合成盐,X与Q同周期且是该周期主族元素中原子半径最小的元素;Z一具有与氩原子相同的电子层结构;Q、Y、W原子的最外层电子数之和为9。下列说法一定正确的是
A.X与Z的简单氢化物的水溶液均呈强酸性
B.Y与Z形成的化合物只含离子键
C.简单氢化物的沸点:Q<X
D.Z和W形成的化合物的水溶液呈碱性
难度: 困难查看答案及解析
-
中华文化源远流长、博大精深。下列有关蕴含的化学知识的说法中,不正确的是
A.食品包装中常见的抗氧化剂成分为:还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀不相同
B.“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦”。黏土烧制陶瓷的过程发生了化学变化
C.“兰陵美酒郁金香,玉碗盛来琥珀光”。粮食发酵产生的酒精分散在酒糟中,可以通过蒸馏分离
D.侯氏制碱法中的“碱”指的是纯碱
难度: 中等查看答案及解析
-
三种有机物之间的转化关系如下,下列说法错误的是
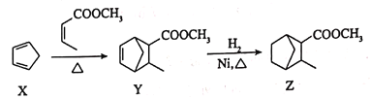
A.X中所有碳原子处于同一平面
B.Y的分子式为
C.由Y生成Z的反应类型为加成反应
D.Z的一氯代物有9种(不含立体异构)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
B.铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
C.1mol CH4与过量氯气发生取代反应,生成CH3Cl气体为NA
D.25℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+
难度: 中等查看答案及解析
-
用KIO3与H2S反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得KIO3;③打开K,通入H2S直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出H2S;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
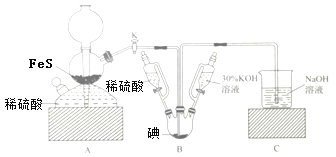
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为3H2S+IO3-═3S↓+3H2O+I-
C.装置C中氢氧化钠溶液的作用是吸收硫化氢
D.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
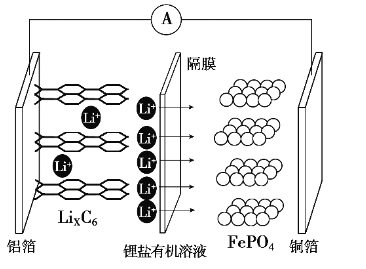
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
难度: 中等查看答案及解析
-
在25℃时,甘氨酸在水溶液中解离情况如下:H3N+CH2COOH(A+)
H3N+CH2COO-(A±)
H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
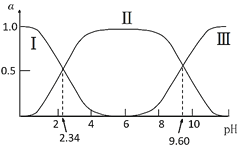
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A−、A±、A+
B.K2=10−2.34,且K2对应的解离基团为-NH3+
C.在pH=9.60的溶液中加盐酸,α(A±)+α(A+)+α(A−)保持不变
D.甘氨酸的等电点pH约为6,且存在c(A±)=c(A+)=c(A−)
难度: 中等查看答案及解析
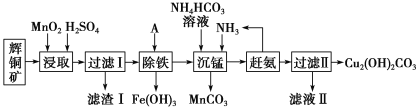
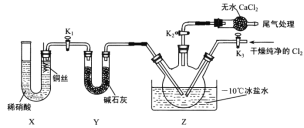
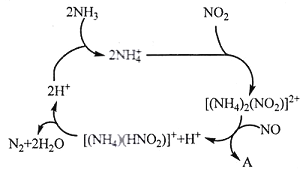
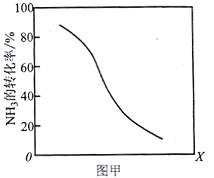
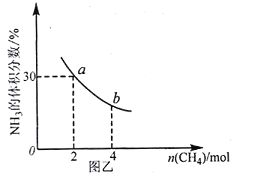
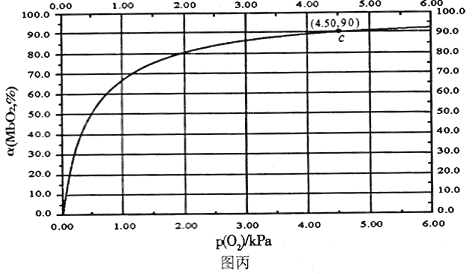
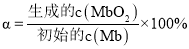 ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。