-
最新科技报道,美国夏威夷联合天文中心的科学家发现了新型的氢粒子,这种粒子是由3个氢原子核(没有中子)和2个电子构成。对这种粒子,下列说法中正确的是( )
A. 是氢的一种新单质 B. 是氢的一种新的同位素
C. 它的组成可用H3表示 D. 它比普通H2分子多一个氢原子核
难度: 简单查看答案及解析
-
将少量氯水加入KI溶液中振荡,再加入CCl4,振荡,静置后观察到的现象是
A. 形成均匀的紫色溶液 B. 有紫色沉淀析出
C. 液体分层,上层呈紫红色 D. 液体分层,下层呈紫红色
难度: 中等查看答案及解析
-
下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Fe>Na
C.酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱:S>C
D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl
难度: 中等查看答案及解析
-
元素的性质呈周期性变化的根本原因是( )
A.元素相对原子质量的递增,量变引起质变
B.元素的原子半径周期性变化
C.元素的金属性和非金属性呈周期性变化
D.元素原子的核外电子排布呈周期性变化
难度: 中等查看答案及解析
-
某元素的阳离子Rn+,核外有x个电子,原子的质量数为A,则该元素原子的中子数为( )
A.A-x-n B.A-x+n C.A+x-n D.A+x+n
难度: 简单查看答案及解析
-
与OH-具有相同质子数和电子数的微粒
A.F- B.NH3 C.H2O D.Na+
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
75
74
主要化合价
+2
+3
+5、-3
-2
下列叙述正确的是( )
A.Y的最高价氧化物对应的水化物显两性
B.放电条件下,Z单质与W的常见单质直接生成ZW2
C.X、Y元素的金属性:X<Y
D.X2+的离子半径大于W2-的离子半径
难度: 中等查看答案及解析
-
下列关于ⅦA族元素的说法中,不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.F-、Cl-、Br-、I-的还原性逐渐增强
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.HF、HCl、HBr、HI水溶液的酸性逐渐减弱
难度: 简单查看答案及解析
-
下列物质既含离子键又含共价键的是( )
A.CaCl2 B.NaOH C.H2O D.Na2O
难度: 简单查看答案及解析
-
下列图中能正确表示X + 3Y = 2Z(放热反应)过程的能量变化的是:
A.
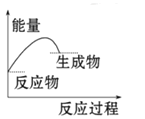
B.
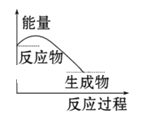
C.
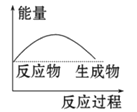
D.
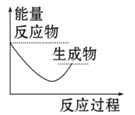
难度: 中等查看答案及解析
-
X、Y、Z均为短周期主族元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-、Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子的最外层电子数:X>Y>Z
B.阴离子还原性:X2-<Z-
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
难度: 中等查看答案及解析
-
对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH<Mg(OH)2<Al(OH)3
B.阳离子氧化性:Na+>Mg2+>Al3+
C.单质的还原性:Na<Mg<Al
D.离子半径:Na+>Mg2+>Al3+
难度: 中等查看答案及解析
-
从宏观来看化学变化的本质是有新物质生成。从微观角度来看,下列变化不能说明发生了化学变化的是 ( )
A. 变化时有电子的得失或共用电子对的形成
B. 变化过程中有化学键的断裂和形成
C. 变化时释放出能量
D. 变化前后原子的种类和数目没有改变,分子种类增加了
难度: 中等查看答案及解析
-
下列关于元素周期表的叙述中正确的是( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除0族外,由长、短周期元素共同组成的元素族称为主族
C.主、副族元素的族序数从左到右都是由小到大排列(如ⅠB~ⅦB)
D.元素周期表共七个横行代表七个周期,18个纵列代表18个族
难度: 中等查看答案及解析
-
已知同周期的X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序为HZO4>H2YO4>H3XO4,下列说法正确的是( )
A.三种元素的原子序数按Z、Y、X的顺序增大
B.单质的氧化性按X、Y、Z的顺序减弱
C.原子半径按X、Y、Z的顺序增大
D.气态氢化物的稳定性按X、Y、Z的顺序增强
难度: 中等查看答案及解析
-
不能比较氮和氧非金属性相对强弱的是
A.氨气在氧气中燃烧生成氮气 B.沸点:H2O>NH3
C.NO中N为+2价,氧为-2价 D.热稳定性:H2O>NH3
难度: 中等查看答案及解析
-
砷为第4周期ⅤA族元素,根据它在元素周期表中位置推测,砷不可能具有的性质是
A.AsH3比NH3稳定 B.可以存在-3、+3、+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4弱 D.砷的非金属性比磷弱
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A.带相反电荷离子之间的相互作用称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属元素原子间不可能形成离子键
难度: 中等查看答案及解析
-
如下图是周期表中短周期的一部分,A.C两种元素的原子核外电子总数之和等于B原子的核内质子数。下列叙述正确的是
A
C
B
A.最高价氧化物对应水化物的酸性:C > B
B.C元素单质是氧化性最强的非金属单质
C.A元素形成的氢化物只有一种
D.B元素位于第三周期VIIA族
难度: 中等查看答案及解析