-
《厉害了,我的国》展示了中国五年来探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是
A.为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属一次能源
B.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、
B.使紫色石蕊溶液变红的溶液中:
、Ba2+、
、Cl-
C.pH=12的溶液中:K+、Na+、CH3COO-、Br-
D.滴加几滴KSCN溶液显血红色的溶液中:
、Mg2+、I-、Cl-
难度: 简单查看答案及解析
-
下列有关实验能达到相应实验目的的是( )
A.
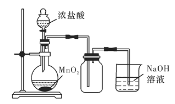 实验室制备氯气 B.
实验室制备氯气 B. 制备干燥的氨气
制备干燥的氨气C.
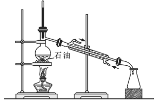 石油分馏制备汽油 D.
石油分馏制备汽油 D.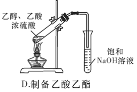 制备乙酸乙酯
制备乙酸乙酯难度: 简单查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的五种元素,A、B形成的简单化合物常用作制冷剂,D原子最外层电子数与最内层电子数相等,化合物DC中两种离子的电子层结构相同,A,B、C、D的原子序数之和是E的两倍。下列说法正确的是
A. 最高价氧化物对应的水化物的酸性:B>E
B. 原子半径:C>B>A
C. 气态氢化物的热稳定性:E>C
D. 化合物DC与EC2中化学键类型相同
难度: 中等查看答案及解析
-
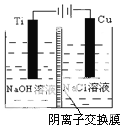
刚结束的两会《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种正负电极反应均涉及氢气的新型“全氢电池”,能量效率可达80%。下列说法中错误的是
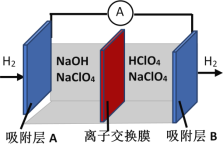
A. 该装置将化学能转换为电能
B. 离子交换膜允许H+和OH-通过
C. 负极为A,其电极反应式是H2-2e- + 2OH- = 2H2O
D. 电池的总反应为H+ + OH-
H2O
难度: 中等查看答案及解析
-
共用两个及两个以上碳原子的多环烃称为桥环烃,共用的碳原子称为桥头碳。桥环烃二环[2.2.0]己烷的碳原子编号为
。下列关于该化合物的说法错误的是( )
A.桥头碳为1号和4号
B.与环己烯互为同分异构体
C.二氯代物有6种(不考虑立体异构)
D.所有碳原子不可能位于同一平面
难度: 简单查看答案及解析
-
25 ℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法不正确的是( )
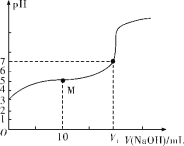
A.HX为弱酸
B.V1<20
C.M点溶液中离子浓度由大到小的顺序:c(X-)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 NaOH溶液和0.1 mol·L-1 HX溶液等体积混合后,溶液中c(Na+)=c(X-)+c(OH-)
难度: 简单查看答案及解析
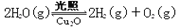 △H>0。水蒸气的浓度随时间t变化如下表所示:
△H>0。水蒸气的浓度随时间t变化如下表所示:
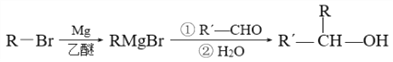
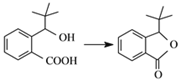 ,则该转化的反应类型是_______________。
,则该转化的反应类型是_______________。