-
一定浓度的盐酸分别与等体积的NaOH溶液和氨水反应,恰好中和,消耗的盐酸体积相同,则NaOH溶液与氨水
A. OH―浓度相等 B. pH相等 C. 电离度相等 D. 物质的量浓度相等
难度: 中等查看答案及解析
-
下列关于能源的说法不正确的是( )
A.地球上最基本的能源是太阳能
B.氢气是重要的绿色能源,贮氢金属、薄膜金属氢化物、某些无机物和某些有机液体氢化物等材料的发展,为解决氢气的贮存问题指明了方向
C.利用植物的秸秆等制沼气、利用玉米制乙醇、使用太阳能热水器、利用生活垃圾发电等过程都涉及了生物质能的利用
D.化石燃料仍是目前世界上能源的最主要来源
难度: 简单查看答案及解析
-
下列变化过程中,△S>0的是( )
A.Na2O(s)和CO2(g)化合生成Na2CO3(s) B.氯气的液化
C.氯化钠固体溶于水 D.氨气与氯化氢化合成氯化铵固体
难度: 简单查看答案及解析
-
一定温度下,密闭容器中发生反应4A(s)+3B(g)⇌2C(g)+D(g),经2 min B的浓度减少0.6 mol•L-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol•L-1•min-1
B.2min末的反应速率v(C)=0.2 mol•L-1•min-1
C.2min内D的物质的量增加0.2mol
D.若起始时A、B的物质的量之比为4∶3,则2 min末A、B的转化率之比为1∶1
难度: 中等查看答案及解析
-
根据下图,下列判断正确的是( )
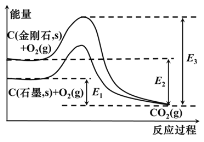
A.石墨与O2生成CO2的反应是吸热反应
B.等量金刚石和石墨完全燃烧,金刚石放出热量更多
C.从能量角度看,金刚石比石墨更稳定
D.C(金刚石,s)=C(石墨,s) △H=E3﹣E4
难度: 简单查看答案及解析
-
下列变化过程,属于放热反应的是
①金属钠与水 ②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌 ③H2在Cl2中燃烧 ④液态水变成水蒸气 ⑤酸碱中和 ⑥碳酸钙热分解
A.①②⑤ B.①③⑤ C.③④⑤ D.②④⑥
难度: 简单查看答案及解析
-
下列物质能促进水的电离的是
A.醋酸 B.醋酸钠 C.乙醇 D.氯化钡
难度: 简单查看答案及解析
-
常温下,将0.05mol/LH2SO4和0.08mol/L NaOH溶液等体积混合,混合液的pH为( )
A.4 B.3 C.2 D.1
难度: 中等查看答案及解析
-
25 ℃时,在0.01 mol·L-1的硫酸溶液中,水电离出的H+浓度是( )
A.5×10-13mol·L-1 B.0.02 mol·L-1 C.1×10-7mol·L-1 D.1×10-12mol·L-1
难度: 简单查看答案及解析
-
下列溶液一定呈中性的是
A. pH=7的溶液 B. c(H+)=c(OH-)=10-6mol/L溶液
C. 使石蕊试液呈紫色的溶液 D. 等体积等浓度的酸与碱反应后的溶液
难度: 中等查看答案及解析
-
下列关于燃烧热的描述中正确的是( )
A. 已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1
B. 将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
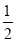 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800kJ·mol-1,则
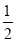 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1难度: 中等查看答案及解析
-
固态或气态碘分别与氢气反应的热化学方程式如下:
①

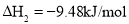
②

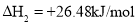
下列判断不正确的是( )
A.①中的
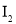 为固态,②中的
为固态,②中的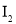 为气态
为气态B.①的反应物总能量比②的反应物总能量高
C.反应①的产物与反应②的产物热稳定性相同
D.1mol 固态碘完全升华会吸热35.96kJ
难度: 简单查看答案及解析
-
在一密闭容器中,加入1molN2和3molH2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) △H<0,则下列说法正确的是( )
A.平衡后其他条件不变只减小体积增大压强,则平衡正向移动
B.平衡后其他条件不变只升高温度,则平衡常数增大
C.平衡后其他条件不变再加入1molN2,则N2转化率增大
D.升高温度逆反应速率增大而正反应速率减小
难度: 中等查看答案及解析
-
在密闭容器中进行反应2SO2+O2
 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①② B. ①③ C. ① D. ③
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌
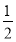 N2(g)+CO2(g)△H=-373.2kJ/mo1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g)△H=-373.2kJ/mo1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入NO D.降低温度同时增大压强
难度: 简单查看答案及解析
-
下列说法不正确的是
A.25℃时,测得0.1mol/L的一元碱MOH溶液pH=11,则MOH一定为弱碱
B.25℃时,将pH=1的H2SO4溶液加水稀释10倍,所得溶液的c(SO42-)为0.005mol/L
C.25℃时,将
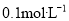 的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/LD.25℃时,pH=12的一元碱MOH溶液与pH=2的盐酸等体积混合,所得溶液pH≤7
难度: 中等查看答案及解析
-
向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法不正确的是( )
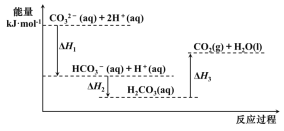
A.反应
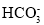 (aq)+H+(aq)═CO2(g)+H2O(l) △H>0
(aq)+H+(aq)═CO2(g)+H2O(l) △H>0B.
 (aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3
(aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3C.△H1>△H2,△H2<△H3
D.H2CO3(aq)═CO2(g)+H2O(l),若使用催化剂,则△H3不变
难度: 中等查看答案及解析
-
利用CO2和CH4重整可制合成气(主要成分为CO、H2),该反应的热化学方程式为CO2(g)+CH4(g)=2CO(g)+2H2(g)△H=xkJ•mol-1
已知①CH4(g)=C(s)+2H2(g)△H=a kJ•mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2(g)=C(s)+H2O(g)△H=c kJ•mol-1则x的数值为( )
A.a+b+2c B.a+2b﹣2c C.a+b﹣2c D.a+b﹣c
难度: 中等查看答案及解析
-
现有等体积的硫酸、盐酸和醋酸三种溶液,将它们分别与V1L、V2L、V3L等浓度的NaOH溶液混合,下列说法中正确的是( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1<V2<V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1=V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后再与足量锌片反应,则醋酸溶液放出气体最多
难度: 困难查看答案及解析
-
水的电离平衡曲线如图所示,下列说法正确的是
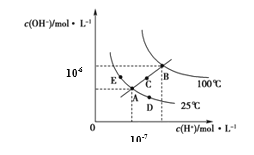
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
难度: 中等查看答案及解析