-
下列有关能源的说法错误的是( )。
A.风能是人类通过风车等工具获取的能源,但属于一次能源
B.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
C.月球土壤中含有丰富的质量数为3的氦,它可作为未来核能的重要原料
D.原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源
难度: 简单查看答案及解析
-
利用Cu+2FeCl3=CuCl2+2FeCl2反应设计一个原电池,下列说法中正确的是( )
A.电极材料为铁和铜,电解质溶液为氯化铁溶液
B.电极材料为铜和石墨,电解质溶液为硝酸铁溶液
C.正极反应式为2Fe3++2e-=2Fe2+
D.负极质量减小,正极质量增加
难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是( )
A.CF2Cl2 B.PCl5 C.HCl D.BF3
难度: 简单查看答案及解析
-
下列关于常见有机物的说法正确的是( )
A.苯能发生取代反应生成氯苯、硝基苯等,但不能发生氧化反应
B.乙烯和乙烷的混合气体可用酸性高锰酸钾溶液分离
C.石油裂解与裂化的原理相同、目的不同
D.光照条件下,控制CH4和Cl2的物质的量之比为1:1,能够制得纯净的CH3Cl和HCl
难度: 中等查看答案及解析
-
“化学是五颜六色的”是指在化学实验中有着丰富多彩的颜色变化。下列有关反应获得的颜色不正确的是( )
①红 ②橙 ③黄 ④绿 ⑤青 ⑥蓝 ⑦紫
A.乙烯气体通入酸性高锰酸钾溶液中:⑦
B.淀粉遇碘:⑥
C.蛋白质遇浓硝酸:③
D.热的氧化铜遇酒精:①
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B.棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
C.绿色化学要求从源头上消除或减少生产活动对环境的污染
D.压缩天然气和液化石油气是我国已经推广使用的清洁燃料
难度: 中等查看答案及解析
-
下列化学用语表述正确的是
A.质子数为6、中子数为8的碳原子:
 C
CB.S2-的离子结构示意图:
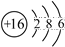
C.乙烯的结构简式:C2H4
D.HCl的电子式:
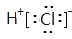
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是
A.灼热的炭与CO2反应 B.铝片与稀硫酸反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在O2中的燃烧
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O
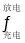 Cd(OH)2+2Ni(OH)2;由此可知,该电池放电时的负极材料是
Cd(OH)2+2Ni(OH)2;由此可知,该电池放电时的负极材料是A.Cd B.Ni(OH)2 C.Cd(OH)2 D.NiO(OH)
难度: 简单查看答案及解析
-
关于化学反应速率的说法正确的是
A.化学反应速率0.8mol·L-1·s-1是指1s时某物质的浓度为0.8mol·L-1
B.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加
C.对于任何化学反应来说,化学反应速率越快,反应现象就越明显
D.根据化学反应速率的大小可知化学反应进行的相对快慢
难度: 中等查看答案及解析
-
在一定条件下,对于A2(g)+3B2(g)
 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=30 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
难度: 中等查看答案及解析
-
下列烷烃在光照下与氯气反应,生成一氯代烃中只有一种结构的是( )
A.
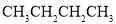 B.
B.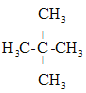
C.
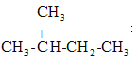 D.
D.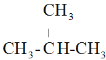
难度: 简单查看答案及解析
-
下列各组物质中,互为同分异构体的是( )
A.水与冰
B.O2与O3
C.
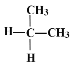 与
与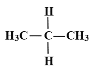
D.
 与
与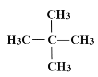
难度: 中等查看答案及解析
-
X、Y、Z、W 均为短周期元素,它们在元素周期表中的位置如图所示,
 ,若 W 原子的最外层电子数是内层电子总数的
,若 W 原子的最外层电子数是内层电子总数的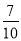 ,下列说法中正确的是( )
,下列说法中正确的是( )A.阴离子的半径从大到小排列顺序为X>Y>Z>W
B.X、Y、Z、W元素的氢化物分子间都可以形成氢键
C.Y的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是
A.含有金属元素的化合物一定是离子化合物
B.第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.离子化合物中可能同时含有离子键和共价键
难度: 简单查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的
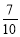 ,下列说法中正确的是
,下列说法中正确的是
A.阴离子的半径从大到小排列顺序为 X>Y>Z>W
B.X、Y、Z、W 元素的氢化物分子间都可以形成氢键
C.Y 的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
难度: 简单查看答案及解析
-
如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率而加入MnO2
D.降温加快H2O2的分解速率
难度: 简单查看答案及解析
-
对于可逆反应2SO2+O2
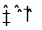 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于O2和SO2中 D.存在于SO2、O2和SO3中
难度: 中等查看答案及解析
-
下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是




A.4.03米大口径碳化硅反射镜
B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线
D.“玉兔二号”钛合金筛网轮
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述错误的是( )
A.植物油能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生水解和氧化反应
D.利用油脂在碱性条件下的水解,可以生产甘油和肥皂
难度: 简单查看答案及解析
-
下列说法错误的是
A.用水鉴别乙醇、苯和溴苯
B.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C.橡胶、蛋白质、尼龙、纤维素都是天然高分子化合物
D.通常所说的三大合成材料是指塑料、合成纤维和合成橡胶
难度: 简单查看答案及解析
-
酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )
A. 酯化反应的产物只有酯 B. 酯化反应可看成取代反应的一种
C. 酯化反应是有限度的 D. 浓硫酸可做酯化反应的催化剂
难度: 中等查看答案及解析
-
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是
A.电池工作时,电子通过外电路从正极流向负极
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解质溶液的碱性保持不变
D.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
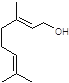
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
难度: 简单查看答案及解析
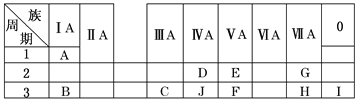
 xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算: