-
新冠肺炎自发现至今已全球扩散,造成巨大损失。75%酒精、含氯消毒剂、过氧乙酸、乙醚和氯仿等脂溶剂均可有效灭杀该病毒。下列有关说法不正确的是
A.过氧乙酸、乙醚和氯仿等都属于有机物
B.将“84”消毒液与75%酒精1:1混合,消毒效果更好
C.等物质的量的含氯消毒剂中ClO2的消毒效果比Cl2更好
D.外出返家时,可用75%酒精喷雾对手、衣服等部位进行消毒
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是
A.淀粉和纤维素互为同分异构体
B.油脂的皂化反应生成高级脂肪酸和甘油
C.氯乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D.“世间丝、麻、裘皆具素质……”,其中的“丝”的主要成分是蛋白质
难度: 简单查看答案及解析
-
下列属于平面三角形的非极性分子的是
A.HCHO B.COCl2 C.BF3 D.NH3
难度: 简单查看答案及解析
-
下列反应不属于取代反应的是
A.苯与浓硝酸制取硝基苯 B.乙醇与浓硫酸140℃制取乙醚
C.乙烯水化法制取乙醇 D.蛋白质水解成氨基酸
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.乙烯的结构简式:CH2CH2 B.乙酸的实验式:CH2O
C.CO2的结构式:O—C—O D.基态铁原子的价电子排布式:3d74s1
难度: 简单查看答案及解析
-
某有机物的分子式为C5H12O,能与金属Na反应放出H2且催化氧化产物能发生银镜反应。则符合要求的该有机物的同分异构数目为
A.4 B.5 C.6 D.7
难度: 简单查看答案及解析
-
衣服上不小心沾到了蓝色墨水,可以先涂上酸性高锰酸钾溶液,即可除去蓝墨水中的鞣酸亚铁,再用乙二酸的稀溶液擦洗,可以迅速除去过量的KMnO4,其反应的离子方程式为MnO
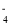 +H2C2O4+H+→CO2↑+Mn2++H2O(未配平)。下列有关叙述不正确的是
+H2C2O4+H+→CO2↑+Mn2++H2O(未配平)。下列有关叙述不正确的是A.每转移2 mol电子,就有1 mol乙二酸被还原
B.氧化剂和还原剂的化学计量数之比是2:5
C.鞣酸亚铁和乙二酸都具有还原性
D.蓝墨水与红墨水混用易因胶体聚沉而导致书写不畅
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数的值,下列说法不正确的是
A.6.4 g Cu与足量浓硫酸加热反应,转移的电子数为0.2NA
B.0.2 mol NO与0.1 mol O2充分反应,产物的分子数小于0.2NA
C.0.1 mol·L-1的NaHSO4溶液中,阴、阳离子的数目之和大于0.2NA
D.20 g质量分数为46%的乙醇水溶液中所含非极性键的数目为0.2NA
难度: 简单查看答案及解析
-
在容积为10 L的恒容密闭容器中发生反应:2A(g)+B(g)
 xC(g)+D(s),A、B、C物质的量随时间的变化关系如图所示,下列说法正确的是
xC(g)+D(s),A、B、C物质的量随时间的变化关系如图所示,下列说法正确的是
A.x=2
B.达平衡时,A的转化率为50%
C.0~10s内B的平均反应速率为0.01 mol/(L·s)
D.当混合气体的总压强保持不变时,可逆反应达到平衡状态
难度: 简单查看答案及解析
-
下列实验操作、现象以及结论完全对应的是
实验操作
实验现象
结论
A
淀粉与稀硫酸混合加热后加入NaOH溶液至碱性,再加入新制Cu(OH)2加热
产生砖红色沉淀
淀粉已发生水解
B
氯乙烷与氢氧化钠溶液混合加热后加入硝酸银溶液
产生白色沉淀
氯乙烷中含有氯元素
C
相同温度下,将相同大小钠块分别加到水、醋酸、乙醇中
生成氢气的速率:醋酸>水>乙醇
三种电解质电离出H+能力:醋酸>水>乙醇
D
室温下,向浓度均为0.01mol/L的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液
出现白色沉淀
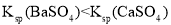
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用图所示装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差。下列有关说法不正确的是
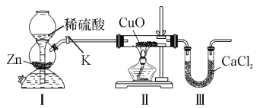
A.装置I(启普发生器)用于制备H2,还可用于大理石与稀盐酸制CO2
B.“点燃酒精灯”和“打开活塞K”这两步操作中间应该进行的操作是检验H2的纯度
C.若Ⅱ装置中玻璃管内有水冷凝,则实验测得的m(H):m(O)<1:8
D.该装置存在的缺陷有:I、II装置之间以及III装置之后缺少干燥装置
难度: 中等查看答案及解析
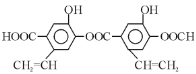 ,下列关于该有机物的说法中不正确的是
,下列关于该有机物的说法中不正确的是
 ]
]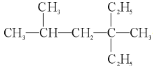 。若A是由炔烃与H2加成得到,则该炔烃的系统名称为:______;若A是由单烯烃与H2加成得到,则这样的单烯烃有_______种。
。若A是由炔烃与H2加成得到,则该炔烃的系统名称为:______;若A是由单烯烃与H2加成得到,则这样的单烯烃有_______种。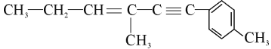 ,请回答:
,请回答: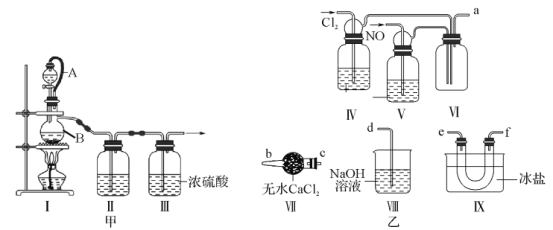
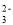 )为____________。
)为____________。 CO2(g)+NO(g) △H=-232.0 kJ·mol-1
CO2(g)+NO(g) △H=-232.0 kJ·mol-1
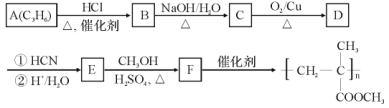
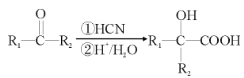 (R1、R2可以是烃基,也可以是H原子)
(R1、R2可以是烃基,也可以是H原子) )是一种高吸水性树脂。参考上述信息,无机试剂任选,设计由乙醇制备聚丙烯酸钠单体的合成线路________。
)是一种高吸水性树脂。参考上述信息,无机试剂任选,设计由乙醇制备聚丙烯酸钠单体的合成线路________。