-
下列由实验得出的结论正确的是
选项
实验
结论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2二溴乙烷无色、可溶于四氯化碳
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
习总书记强调“要建设天蓝、地绿、水清的美丽中国,让老百姓在宜居的环境中享受生活。”下列做法与此不相符合的是
A. 将煤进行气化处理,既提高煤的综合利用效率,又可减少酸雨的危害
B. 将废旧电池进行直接填埋,减少对环境的污染
C. 开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
D. 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. Cl‑离子的结构示意图:
 B. 甲烷的球棍模型:
B. 甲烷的球棍模型:
C. 乙酸的结构简式:C2H4O2 D. HCl分子的电子式:
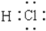
难度: 简单查看答案及解析
-
含有共价键的离子化合物是
A. KOH B. H2O C. CaCl2 D. HNO3
难度: 简单查看答案及解析
-
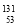 I可用于治疗甲状腺疾病。该原子的中子数与质子数之差是
I可用于治疗甲状腺疾病。该原子的中子数与质子数之差是A. 53 B. 25 C. 78 D. 184
难度: 简单查看答案及解析
-
下列二者间关系的描述正确的是
A.CH3CH2OH和CH3OCH3互为同分异构体 B.14C与14N互为同位素
C.H2和D2互为同素异形体 D.CH2BrCH2Br和CH3CHBr2是同种物质
难度: 简单查看答案及解析
-
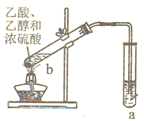
下列装置或操作能达到实验目的的是
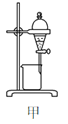

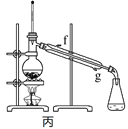

A. 除去乙醇中的乙酸用图甲装置
B. 除去甲烷中混有的乙烯用图乙装置
C. 用自来水制取少量的蒸馏水用图丙装置
D. 证明氯的非金属性比碳强可用图丁装置
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol碳正离子CH5+所含的电子数为10NA
B. 7.8g的苯中含有碳碳双键的数目为0.3NA
C. 标准状况下,2.24L乙醇含有的氧原子数目约为0.1NA
D. 4.6g Na与100 mL1.0 mol/L醋酸溶液反应,转移电子数目为0.1NA
难度: 中等查看答案及解析
-
下列物质转化常通过加成反应实现的是
A.
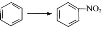 B.CH3CHO → CH3COOH
B.CH3CHO → CH3COOHC.CH4 → CH3Cl D.CH2=CH2 → CH3CH2Br
难度: 简单查看答案及解析
-
能说明反应X(g)+2Y(g)
 2Z(g)达到化学平衡状态的是
2Z(g)达到化学平衡状态的是A. X、Y、Z的物质的量之比为1:2:2 B. X、Y、Z的浓度不再发生变化
C. 反应速率v(X)= v(Y) D. 单位时间内生成n mol Z的同时生成2n mol Y
难度: 简单查看答案及解析
-
一定温度下,将 2 mol SO2 和 1 mol O2 充入2L密闭容器中,在催化剂存在下进行下列反应: 2SO2+ O2
 2SO3,下列说法中正确的是
2SO3,下列说法中正确的是A. 达到反应限度时,生成2molSO3
B. 达到反应限度时SO2的消耗速率必定等于O2的生成速率
C. 达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D. SO2和SO3物质的量之和一定为 2mol
难度: 简单查看答案及解析
-
某有机物的结构式为:
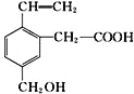 ,它在一定条件下可能发生的反应有①加成②水解③酯化④氧化⑤中和⑥加聚
,它在一定条件下可能发生的反应有①加成②水解③酯化④氧化⑤中和⑥加聚A.②③④ B.①③④⑤ C.①③④⑤⑥ D.②③④⑤⑥
难度: 中等查看答案及解析
-
W、X、Y、Z、M、R为6种短周期主族元素。W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与M原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如下图所示。下列说法正确的是
Z
M
R
Y
A. R元素的最高正价为+6 B. 原子半径:r(Y)>r(X)>r(Z)>r(M)
C. X的金属性比Y的金属性弱 D. 由X和R组成的化合物不止一种
难度: 中等查看答案及解析
-
原电池结构如图所示,下列有关该原电池的说法正确的是

A.能将电能转换成化学能
B.电子从碳棒经外电路流向铁棒
C.碳棒发生氧化反应
D.总反应为 Fe+H2SO4= FeSO4+H2↑
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素。Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族。下列说法正确的是
A.原子半径:r(X)<r(Y)<r(Z)<r(W) B.电解由Y、Z组成的化合物可获得Z的单质
C.W的简单气态氢化物的热稳定性比Y的强 D.由X、Y组成的化合物只有两种
难度: 中等查看答案及解析
-
丁烷可发生反应:C4H10
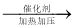 C2H6+C2H4,C4H10
C2H6+C2H4,C4H10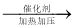 CH4+CH3CH=CH2,假定丁烷只按上述方式完全裂解,将m g裂解气缓缓通过盛有足量Br2 的CCl4溶液(不考虑Br2和CCl4 挥发)的洗气瓶,充分吸收,溶液增重恰好为
CH4+CH3CH=CH2,假定丁烷只按上述方式完全裂解,将m g裂解气缓缓通过盛有足量Br2 的CCl4溶液(不考虑Br2和CCl4 挥发)的洗气瓶,充分吸收,溶液增重恰好为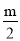 g,则裂解气中
g,则裂解气中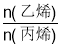 为
为A.13 B.9 C.7 D.1
难度: 简单查看答案及解析
-
德国化学家 F.Haber 利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微 观历程及能量变化的示意图如下,用
 、
、  、
、 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是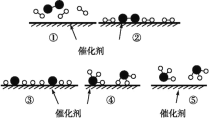

A.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
B.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C.在该过程中,N2、H2断键形成氮原子和氢原子
D.使用催化剂,合成氨反应放出的热量减少
难度: 中等查看答案及解析
-
下列有关实验说法不正确的是( )
A.萃取
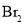 时,向盛有溴水的分液漏斗中加入
时,向盛有溴水的分液漏斗中加入 ,振荡、静置分层后,打开旋塞,先将水层放出
,振荡、静置分层后,打开旋塞,先将水层放出B.做焰色试验前,铂丝用稀盐酸清洗并灼烧至火焰呈无色
C.乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞
D.可用
 溶液和稀
溶液和稀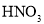 区分
区分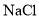 、
、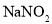 和
和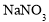
难度: 中等查看答案及解析
-
1934年约里奥–居里夫妇在核反应中用α粒子(即氦核
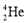 )轰击金属原子
)轰击金属原子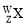 ,得到核素
,得到核素 ,开创了人造放射性核素的先河:
,开创了人造放射性核素的先河: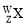 +
+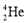 →
→ +
+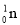 。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是A.
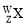 的相对原子质量为26
的相对原子质量为26B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
难度: 中等查看答案及解析
-
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是
A.淀粉
 葡萄糖
葡萄糖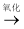 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)B.纤维素
 葡萄糖
葡萄糖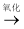 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)C.油脂
 甘油和高级脂肪酸
甘油和高级脂肪酸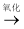 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)D.蛋白质
 氨基酸
氨基酸 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)难度: 简单查看答案及解析
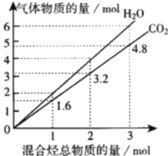
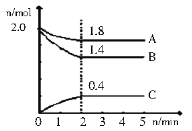
 CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的物质的量随时间变化如图所示。下列描述正确的是( )
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的物质的量随时间变化如图所示。下列描述正确的是( )
 ,其二氯取代物有1种结构
,其二氯取代物有1种结构
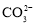 =________
=________ +_Br-+_CO2↑
+_Br-+_CO2↑ +7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题:
+7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题: 2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为________________。
2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为________________。