-
下列叙述正确的是(NA代表阿伏加德罗常数的值)
A. 将22.4 L HCl配成1 L溶液,c(H+)为1 mol/L
B. 2 L 2 mol/L的盐酸,c(H+)为2 mol/L
C. 从100 mL 2 mol/L的盐酸取出10 mL,c(H+)为0.2 mol/L
D. 1 mol/L 的盐酸中所含Cl-数目为NA
难度: 中等查看答案及解析
-
向BaCl2溶液中通入SO2气体,溶液仍然澄清;若将BaCl2溶液分盛在两支试管中,一只试管加稀HNO3,另一只加NaOH溶液,然后再通入SO2气体,结果两支试管都有白色沉淀产生。由此得出的下列结论中不合理的是
A.SO2是酸性氧化物、SO2具有还原性
B.两支试管中的白色沉淀不是同种物质
C.BaCl2既能跟强酸、又能跟强碱反应,具有两性
D.升高pH时,SO2水溶液中SO32-浓度增大
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A. 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B. 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C. 硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D. Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
难度: 中等查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”共同获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有丙烯、戊醇、苯,下列说法不正确的是
A.苯与溴水混合会发生取代反应
B.丙烯能使溴水褪色
C.戊醇与乙醇都含有羟基
D.苯与足量氢气在镍催化作用下会发生加成反应生成环己烷
难度: 简单查看答案及解析
-
下列实验装置或原理能达到实验目的的是
A. 分离水和乙醇
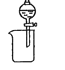
B. 除去 Cl2 中的 HCl
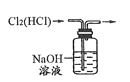
C. 实验室制氨气

D. 排水法收集 NO

难度: 简单查看答案及解析
-
中国最新战机歼-31使用了高强度、耐高温的钛合金材料,工业上冶炼钛的反应如下:
 ,下列有关该反应的说法正确的是
,下列有关该反应的说法正确的是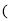
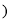
A.
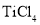 是还原剂 B.Mg被氧化
是还原剂 B.Mg被氧化C.
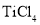 发生氧化反应 D.Mg得到电子
发生氧化反应 D.Mg得到电子难度: 简单查看答案及解析
-
下列说法中正确的是
A.干冰、盐酸都是电解质
B.Na2O2、Fe2O3、CaO既属于碱性氧化物,又属于离子化合物
C.有单质参加或有单质生成的反应不一定属于氧化还原反应
D.根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体
难度: 简单查看答案及解析
-
下列物质既含有极性键,又含有非极性键的是( )
A.NH3 B.CH4 C.CO2 D.C2H6
难度: 简单查看答案及解析
-
正确掌握化学用语是学好化学的基础,下列有关化学用语表示正确的是( )
A.中子数为10的氧原子:
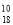 O
OB.Na2S的电子式:

C.乙酸的球棍模型:
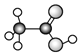
D.次氯酸的电子式:
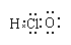
难度: 简单查看答案及解析
-
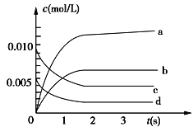
已知:2A(g)+3B(g)
 2C(g)+zD(g),现将2 mol A与2 mol B混合于2 L的密闭容器中,2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
2C(g)+zD(g),现将2 mol A与2 mol B混合于2 L的密闭容器中,2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是A.v(C)=0.2 mol·L-1·s-1 B.z=1
C.B的转化率为25% D.C平衡时的浓度为0.5mol·L-1
难度: 中等查看答案及解析
-
下列微粒在所给条件下,一定可以大量共存的是( )
A.透明溶液中:SCN-、NO
 、Na+、Fe3+
、Na+、Fe3+B.遇酚酞显红色的溶液中:Cl2、Mg2+、I-、SO
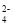
C.与铝反应能产生大量氢气的溶液中:HCO
 、K+、Cl-、CH3COO-
、K+、Cl-、CH3COO-D.酸性溶液中:Fe2+、Al3+、SO
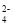 、NH
、NH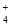
难度: 简单查看答案及解析
-
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆−氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2−)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
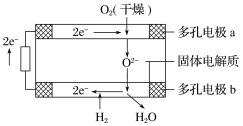
A.有O2放电的a极为电池的负极
B.O2−移向电池的正极
C.b极对应的电极反应为2H2−4e−+2O2−
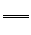 2H2O
2H2OD.a极对应的电极反应为O2+2H2O+4e−
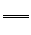 4OH−
4OH−难度: 中等查看答案及解析
-
满足分子式为C5H11Cl的有机物共有
A.6种 B.7种 C.8种 D.9种
难度: 中等查看答案及解析
-
下列关于资源综合利用的说法中,错误的是( )
A.石油主要是由气态烃、液态烃和固态烃组成的混合物
B.轻质油常压蒸馏的主要产品为汽油、煤油和柴油
C.催化裂化的目的是提高汽油、煤油和柴油等轻质油的产量
D.煤的干馏和石油的分馏均属化学变化
难度: 简单查看答案及解析
-
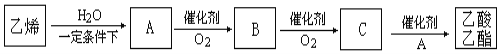
绿色化学对于化学反应提出了原子经济性的要求。最理想的原子经济性反应是反应物中的原子全部转化为期望的最终产物,没有副产物,实现零排放。下列几种生产乙苯(
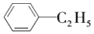 )的方法和过程中,最符合原子经济性要求的是( )
)的方法和过程中,最符合原子经济性要求的是( )A.
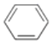 +C2H5Cl
+C2H5Cl
 +HCl
+HClB.
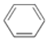 +C2H5OH
+C2H5OH
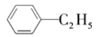 +H2O
+H2OC.
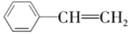 +H2
+H2
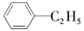
D.
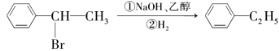
难度: 中等查看答案及解析
-
有八种物质:①甲烷 ②苯 ③聚乙烯 ④1,3-丁二烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯⑧环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
A.①④⑤⑧ B.②⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,X的最高价氧化物对应的水化物的化学式为H2XO3,Y的最外层电子数是电子层数的3倍,Z是地壳中含量最高的金属元素,W的一种核素的质量数为28,中子数为14。下列说法正确的是( )
A.Z2Y3、WX分别是离子化合物、共价化合物
B.元素的非金属性W>Y>X
C.原子半径由大到小的顺序是Z>W>Y>X
D.X、Z、W的最高价氧化物都是酸性氧化物
难度: 简单查看答案及解析
-
下列说法中正确的一组是( )
A.
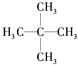 和C(CH3)4是同一种物质
和C(CH3)4是同一种物质B.H2和D2互为同位素
C.正丁烷和异丁烷是同系物
D.
 互为同分异构体
互为同分异构体难度: 中等查看答案及解析
-
从海水中提取镁的工艺流程可表示如下:
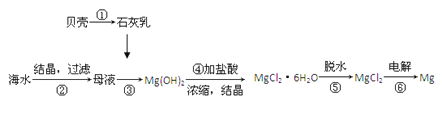
下列说法不正确的是
A. 用此法提取镁的优点之一是原料来源丰富
B. 步骤⑥电解熔融MgCl2时可制得Mg(OH)2
C. 步骤⑤可将晶体置于HCl气体氛围中脱水
D. 上述工艺流程中涉及化合、分解和复分解反应
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH﹣===CaCO3↓+H2O
B.NaHCO3溶液与NaOH溶液反应:OH﹣+ HCO3-===CO32- +H2O
C.金属钠投入硫酸铜溶液中:Cu2++2Na == Cu + 2Na+
D.铁溶于稀硝酸,溶液变黄:3Fe+8H++NO3-== 3Fe2++2NO↑+4H2O
难度: 中等查看答案及解析