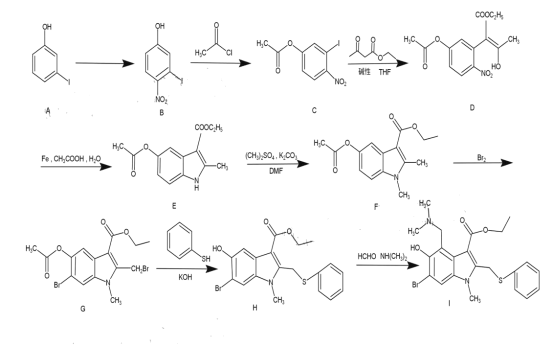
-
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.蛋白质在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
B.丝绸的主要成分是天然纤维素,属于高分子化合物
C.高铁车用大部分材料是铝合金,铝合金材料具有质量轻、抗腐蚀能力强等优点
D.中秋节吃月饼,为防止月饼富脂易变质,常在包装袋中加入生石灰
难度: 简单查看答案及解析
-
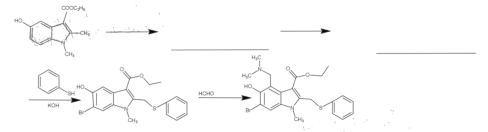
桥环化合物是指化合物中的任意两个环共用两个不直接相连的碳原子的环烃,二环[1,1,0]丁烷(
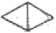 )是最简单的一种桥环有机物。下列关于该化合物的说法正确的是
)是最简单的一种桥环有机物。下列关于该化合物的说法正确的是A.其同分异构体中呈环状的只有环丁烯(
 )
)B.构成该化合物的所有原子处于同一个平面
C.二环[1,1,0]丁烷和甲烷互为同系物
D.二环[1,1,0]丁烷的二溴代物为4种
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是
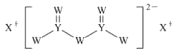
A.Y单质的熔点高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.Z元素在自然界中既有游离态也有化合态
D.1moIW 和X形成的化合物中可能含有4mol离子
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A.乙烯和环丁烷(C4H8)的混合气体共28g含有的原子数目为6NA
B.0.1 mol羟基中所含有的电子数为NA
C.1 L0.1 mol·L-1 Na2S溶液中,S2-、 HS-和H2S的微粒数之和为0.1NA
D.在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若反应中电子转移的数目为10NA则有424g氯气生成
难度: 困难查看答案及解析
-
对下列实验现象或操作解释正确的是
现象或操作
解释
A
KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去
SO2具有漂白性
B
配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用
蒸馏水稀释,最后在试剂瓶中加入少量的铁粉
抑制Fe3+水解,并防止Fe3+变质
C
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
不能说明该溶液中一定含有SO42–
D
向含有Cu(NO3)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀
Ksp(Ag2S)<Ksp(CuS)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
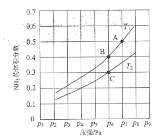
尿素在生产生活中应用非常广泛,2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(l)是工业上合成氮肥尿素的主要方法,在生产条件下,单位时间内获得尿素的产量与压强及n(NH3):n(CO2)的关 系如图甲所示。当氨碳比n(NH3):n(CO2)=4 时,CO2的转化率随时间的变化关系如图乙所示。下列说法不正确的是

A.生产过程中n(NH3):n(CO2)的 最佳配比为2:1
B.若开始投料按照n(NH3):n(CO2)为2:1投料,平衡后若压缩容器的体积,则再次平衡时c(NH3)比压缩前小
C.A点的逆反应速率小于B点的正反应速率
D.由图乙可知NH3的平衡转化率为30%
难度: 困难查看答案及解析
-
常温下,向20mL 0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
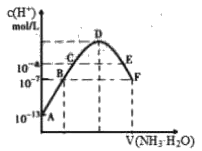
A.NaHB溶液可能为酸性,也可能为碱性
B.A、B、 C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.B点溶液c(NH4+)=2c(B2-)
D.E溶液中离子浓度大小关系:c(NH4 +)> c(B2-)> c(H+)>c(OH-)
难度: 困难查看答案及解析
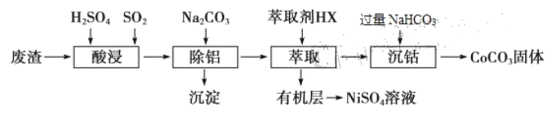
 Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。
Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。