-
下列物质中,既有离子键又有共价键的是( )
A. MgCl2 B. Ca(OH)2 C. H2O D. N2
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 在共价化合物中一定含有共价键
B. 含有离子键的化合物一定是离子化合物
C. 含有共价键的化合物一定是共价化合物
D. 化学反应过程中,反应物分子内的化学键断裂,产物分子的化学键形成
难度: 中等查看答案及解析
-
下列关于CS2、SO2、NH3三种物质的说法正确的是( )
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,在三种物质中熔沸点最低
D.NH3在水中溶解度很大只是因为NH3是极性分子
难度: 简单查看答案及解析
-
下列中心原子的杂化轨道类型和分子几何构型均不正确的是( )
A.CCl4中C原子sp3杂化,为正四面体形
B.BF3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S分子中,S为sp杂化,为直线形
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.同一原子中3s、3p、3d、4s能量依次升高
B.某原子核外电子由1s22s22p63s23p1→1s22s22p63s13p2,原子放出能量
C.p能级的原子轨道呈哑铃形,随着能层数的增加,p能级原子轨道数也在增多
D.按照泡利原理,在同一个原子中不可能存在两个运动状态完全相同的电子
难度: 中等查看答案及解析
-
下列有关微粒性质的排列顺序正确的是
A.离子半径:O2->Na+>S2-
B.第一电离能:O>N>C
C.电负性:F>P>O
D.基态原子中未成对电子数:Mn>Si>Cl
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.HCl的电子式为
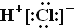 B.Cl-的结构示意图
B.Cl-的结构示意图 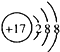
C.CO2的电子式
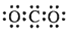 D.质量数为37的氯原子
D.质量数为37的氯原子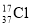
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.14C中含有14个中子 B.1H、2H、3H是同一种核素
C.H2O与D2O互称同位素 D.C60、金刚石、石墨均为碳的同素异形体
难度: 中等查看答案及解析
-
下列关于第一电离能大小的比较正确的是
A.K>Ca>Ga B.Li>Na>K
C.S>P>Al D.H>N>Ne
难度: 中等查看答案及解析
-
下列分子中σ键与π键数之比为3:1的是
A.N2 B.C2H4 C.HCHO D.HCN
难度: 简单查看答案及解析
-
下列关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物的说法中正确的是
A.配体是C1-和H2O,配位数是9
B.中心离子是Ti3+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl-的数目比是2:1
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
难度: 中等查看答案及解析
-
下列各组微粒的立体构型相同的是
A.C与SO2 B.CH4与CCl4 C.NH3与BF3 D.H3O+与SO3
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B. H2O的熔、沸点高于H2S是由于H2O分子间存在氢键
C. 甲烷可与水形成氢键
D. 白酒中,乙醇分子和水分子间存在范德华力和氢键
难度: 中等查看答案及解析
-
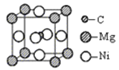
如图为某晶体的一个晶胞。该晶体由A、B、C三种基本粒子组成。试根据图示判断,该晶体的化学式是( )
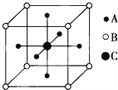
A.A6B8C B.A2B4C C.A3BC D.A3B4C
难度: 中等查看答案及解析
-
根据表中给出物质的熔点数据(AlCl3沸点为180 ℃),判断下列说法错误的是( )
晶体
NaCl
MgO
SiCl4
AlCl3
晶体硼
熔点/℃
801
2 800
-70
194
2500
A.MgO中的离子键比NaCl中的离子键强
B.SiCl4晶体是分子晶体
C.AlCl3晶体是离子晶体
D.晶体硼是原子晶体
难度: 简单查看答案及解析
-
下面有关晶体的叙述中,正确的是
A.原子晶体中只存在非极性共价键
B.在氯化钠晶体中每个Na+周围都紧邻8个Cl-
C.离子晶体在熔化时,离子键被破坏
D.熔融状态下导电的晶体一定是金属晶体
难度: 简单查看答案及解析
-
下列说法错误的是
A.鉴别晶体和非晶体最可靠的方法是X射线衍射实验
B.H2O沸点高于CH4的原因与分子间氢键有关
C.NaF、NaCl、NaBr、NaI的晶格能依次增大,熔点依次升高
D.用电子气理论可以解释金属的良好导电性
难度: 简单查看答案及解析
-
关于下列四种金属堆积模型的说法正确的是( )
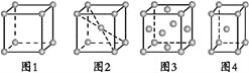
A.图1和图4为非密置层堆积,图2和图3为密置层堆积
B.图1~图4分别是简单立方堆积、体心立方堆积、面心立方堆积、体心立方堆积
C.图1~图4每个晶胞所含有原子数分别为1、2、2、4
D.图1~图4堆积方式的空间利用率分别为52%、68%、74%、74%
难度: 中等查看答案及解析
-
下列说法正确的是
A.分子晶体中一定不存在离子键,但一定存在共价键
B.H2O2和Na2O均属于离子化合物
C.加热氯化铵和加热碘单质克服的作用力均为分子间作用力
D.P4和SCl2两种分子中,每个原子的最外层都满足8电子稳定结构
难度: 简单查看答案及解析
-
已知在晶体中仍保持一定几何形状的最小单位称为晶胞。干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子。实验测得25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)
A.
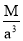 B.
B.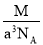 C.
C.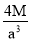 D.
D.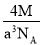
难度: 中等查看答案及解析
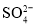 的空间构型为_______形,其中硫原子采用______杂化。
的空间构型为_______形,其中硫原子采用______杂化。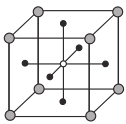
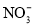 中,N原子的杂化方式为________,写出一种与
中,N原子的杂化方式为________,写出一种与