-
某种新型药物的化学式为C5H4N3O2F,下列关于这种药物的说法中正确的是( )
A.这种药物是混合物
B.这种药物中碳元素和氢元素的质量比为5 : 4
C.这种药物中含有2个氢分子
D.这种药物由碳、氢、氮、氧、氟五种元素组成
难度: 简单查看答案及解析
-
下列各组物质能大量共存并形成无色溶液的是( )
A. 硫酸亚铁、氯化钾、硫酸钠
B. 硝酸银、硝酸钾、氯化钠
C. 硫酸、氯化钠、硝酸钡
D. 氯化镁、硝酸钠、硫酸钾
难度: 中等查看答案及解析
-
有一包白色粉末,可能由NaCl、Na2SO4、CuSO4、Na2CO3、CaCO3中的一种或几种组成,为确定其组成,进行如下实验:( )
①称取一定质量的该白色粉末加足量水溶解,得无色溶液 A;
②在无色溶液 A 中加入过量BaCl2溶液,充分反应后过滤,分别得无色溶液 B 和白色沉淀C;将白色沉淀 C 洗涤,烘干后称得质量为 20g;
③在 20g 白色沉淀 C 中加入足量的稀硝酸,沉淀部分消失,并有气泡冒出;
④在无色溶液 B 中滴加AgNO3溶液和稀硝酸,产生白色淀。
由上述实验得出的下列判断中,正确的是
A.白色粉末中一定含有NaCl
B.无色溶液 B 中只含有一种溶质
C.步骤③生成的气体质量可能是 4.4g
D.白色粉末中不含CaCO3、CuSO4、Na2SO4
难度: 中等查看答案及解析
-
下列物质所对应的用途不正确的是
A.金刚石——用于制造轻轨电刷 B.干冰——用于人工降雨
C.氢氧化钠——电解水时增强导电性 D.钛合金——制造人造骨
难度: 中等查看答案及解析
-
除去食盐溶液中的Na2SO4和CaCl2杂质的操作有:①加入过量BaCl2溶液;②过滤;③加入适量盐酸;④蒸发结晶;⑤加入过量Na2CO3溶液,正确的操作顺序是( )
A.
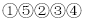 B.
B.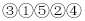
C.
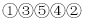 D.
D.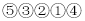
难度: 中等查看答案及解析
-
下列选项中物质的名称、俗名、化学式、类别、用途完全对应的是( )
A.碳酸钠 石碱
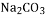 碱 制玻璃
碱 制玻璃B.氧化钙 熟石灰
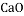 氧化物 补钙剂
氧化物 补钙剂C.硫酸铜 胆矾
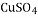 酸 制农药
酸 制农药D.氢氧化钠 苛性钠
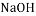 碱 人造棉
碱 人造棉难度: 简单查看答案及解析
-
在甲组物质中加入乙组物质,反应过程中产生的沉淀的质量与加入乙的质量的关系,符合如图所示关系的是
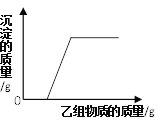
A. 甲组:硫酸钠和硫酸铜的混合溶液,乙组:氢氧化钠溶液;
B. 甲组:氯化钠和氯化钙的混合溶液,乙组:纯碱溶液;
C. 甲组:稀盐酸和氯化钡的混合溶液,乙组:纯碱溶液;
D. 甲组:稀盐酸和稀硫酸的混合溶液,乙组:氯化钡溶液;
难度: 中等查看答案及解析
-
在甲组物质中加入乙组物质,反应过程中产生的沉淀的质量与加入乙的质量的关系,符合如图所示关系的是
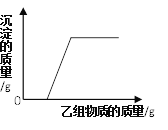
A. 甲组:硫酸钠和硫酸铜的混合溶液,乙组:氢氧化钠溶液;
B. 甲组:氯化钠和氯化钙的混合溶液,乙组:纯碱溶液;
C. 甲组:稀盐酸和氯化钡的混合溶液,乙组:纯碱溶液;
D. 甲组:稀盐酸和稀硫酸的混合溶液,乙组:氯化钡溶液;
难度: 中等查看答案及解析
-
甲、乙两种固体的溶解度曲线如下图所示,t2°C时,分别取含水100g的甲、乙物质的饱和溶液,将其降温至0°C,下列说法中正确的是( )
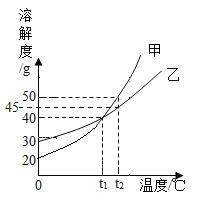
A.t1°C时, 甲的饱和溶液中溶质和溶液的质量比为1:2
B.降温过程中,所得溶液质量甲始终大于乙
C.降温至t1°C时, 所得溶液溶质质量分数相等,且溶液中溶质质量甲等于乙
D.降温至0°C时,溶液中析出固体的质量一定为甲小于乙
难度: 困难查看答案及解析
-
有一包白色固体样品,可能由CaCO3、NaOH、MgCl2、Na2SO4和BaCl2中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
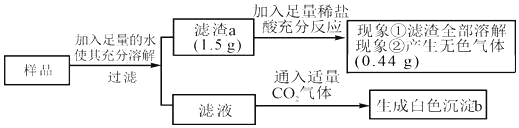
下列判断正确的是( )
A. 原固体样品中一定有CaCO3、NaOH、MgCl2、BaCl2,可能有Na2SO4
B. 滤液中溶质的成分是NaOH、BaCl2
C. 滤渣a的成分是CaCO3
D. 若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中仍能确定是否存在MgCl2
难度: 困难查看答案及解析
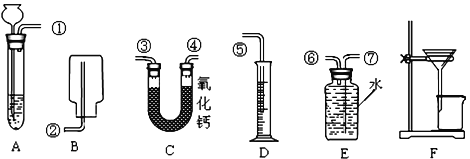
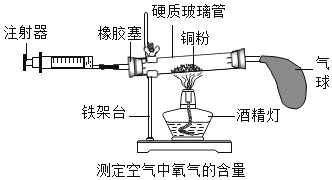
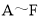 是初中化学常见的物质,他们之间的转化关系如图所示。已知F是人体主要的供能物质,部分反应条件已省略。请回答下列问题:
是初中化学常见的物质,他们之间的转化关系如图所示。已知F是人体主要的供能物质,部分反应条件已省略。请回答下列问题: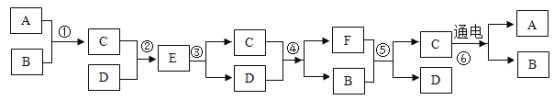
 写一条即可
写一条即可 :______________。
:______________。 的化学方程式:______________。
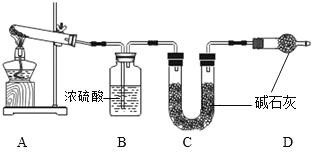
的化学方程式:______________。 Na2CO3 + CO2↑+ H2O,杂质不参加反应。碱石灰是NaOH和CaO的固体混合物。)
Na2CO3 + CO2↑+ H2O,杂质不参加反应。碱石灰是NaOH和CaO的固体混合物。)