-
化学与生产、生活密切相关,下列说法不正确的是
A.MgO熔点高,可作耐高温材料
B.酒精和“84消毒液”的消毒原理不相同
C.常用投加明矾、硫酸铁等电解质的方法来处理浑浊的水
D.汽车尾气中的氮氧化合物主要源自汽油中含氮化合物与氧气反应的产物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,2.24LHF含有的分子数为0.lNA
B.1mol/LBaCl2溶液中,Ba2+和Cl-总数为3NA
C.标准状况下,2.24LCO和CO2的混合物中,含有碳原子数目为0.1NA
D.常温常压下,1mol(NH4)2SO4溶液中含有
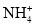 为2NA
为2NA难度: 中等查看答案及解析
-
下列指定反应的化学方程式或离子方程式正确的是
A.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
B.0.1mol/L的H2C2O4的pH=1.3,向酸性KMnO4溶液中滴入草酸溶液紫色褪去:2
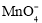 +5H2C2O4+6H+=2Mn2++10CO2↑+H2O
+5H2C2O4+6H+=2Mn2++10CO2↑+H2OC.室温下用稀硝酸溶解铜:Cu+2
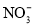 +2H+=Cu2++2NO2↑+H2O
+2H+=Cu2++2NO2↑+H2OD.用铝粉和氢氧化钠溶液反应制取少量H2:Al+2OH-=
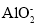 +H2↑
+H2↑难度: 中等查看答案及解析
-
关于化合物苯乙烯,
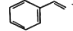 下列说法正确的是
下列说法正确的是A.不能使溴水褪色
B.可以发生加成聚合、氧化、取代反应
C.易溶于水和甲苯
D.分子中所有碳原子不可能共平面。
难度: 中等查看答案及解析
-
今年是门捷列夫发现元素周期律151周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法正确的是
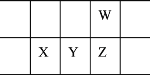
A.X的最高价氧化物的水化物能与硫酸反应,又能与NaOH溶液反应
B.常温常压下,Y单质是现代光学和光纤的基本原料
C.气态氢化物热稳定性:Z>W
D.原子半径:W>X
难度: 中等查看答案及解析
-
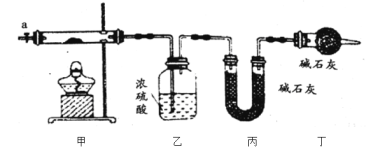
对下列实验的描述不正确的是

A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)⇌ N2O4(g)是放热反应
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是
A.0.1mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O溶液中:c(
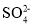 )>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
D.0.1mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(
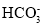 )+c(
)+c( )+c(OH-)
)+c(OH-)难度: 中等查看答案及解析
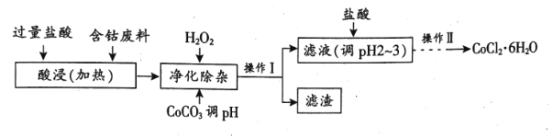
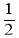 C2H4(g)+2H2O(g),若反应体系的能量随反应过程变化关系如图所示:
C2H4(g)+2H2O(g),若反应体系的能量随反应过程变化关系如图所示: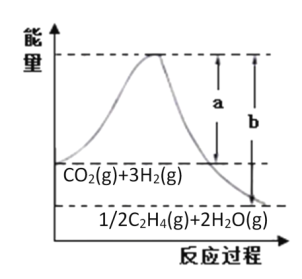
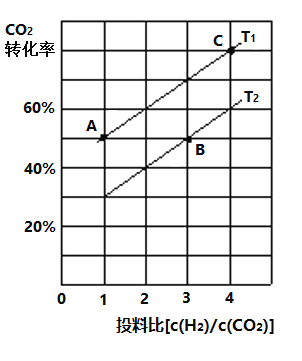
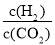 比值减小
比值减小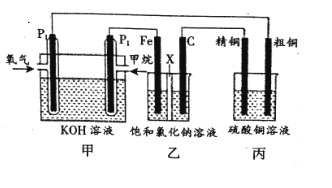

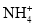 ,这个过程发生改变的是______(填序号)
,这个过程发生改变的是______(填序号)


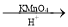 R1COOH+R2COOH
R1COOH+R2COOH