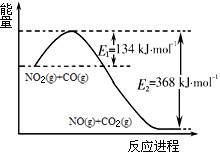
-
下图表示某物质发生的是
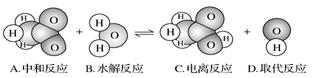
难度: 简单查看答案及解析
-
下列叙述正确的是
A.CH4O和C2H6O一定互为同系物
B.16 g CH4与18 g NH4+所含质子数相等
C.32S与33S的核外电子数相等,是同一种核素
D.质量相等、体积不等的N2和C2H4的分子数相等
难度: 简单查看答案及解析
-
下列实验与物质微粒大小无直接关系的是
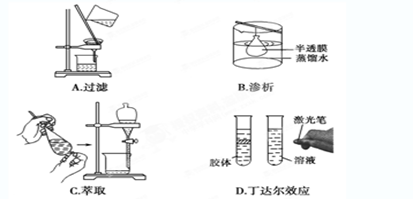
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊
D.水中加入明矾可以净化水
难度: 简单查看答案及解析
-
下列说法不正确的是
A.维生素C具有还原性,可用作食品抗氧化剂
B.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
C.向含有Hg2+的废水中加入Na2S,使Hg2+转化成HgS沉淀除去
D.淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应
难度: 简单查看答案及解析
-
下列实验操作不能达到其对应目的的是
编号
实验操作
目的
A
取4 g NaOH加入96 mL水中
(水的密度近似看作1 g/cm3)
配制4 % NaOH溶液
B
滴定实验中,用待测液润洗锥形瓶
避免造成误差使滴定结果偏低
C
向CH3COONa溶液中滴入酚酞溶液,加热
证明升高温度能促进CH3COONa水解
D
向盛有铜片的试管中加入浓硫酸,加热
证明浓硫酸具有强氧化性
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A.已知:2H2(g)+O2(g) = 2H2O(g) ΔH=-483.6 kJ/mol,氢气的燃烧热为241.8 kJ/mol
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓
C.某反应⊿H<0,ΔS>0,则该反应在任意条件下均可自发进行。
D.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S
难度: 简单查看答案及解析
-
已知:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
A.升高温度能使
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
难度: 简单查看答案及解析
-
下列事实中不能用勒夏特列原理来解释的是
A.向SO2水溶液中加盐酸有利于SO32-离子浓度的减少
B.加入催化剂有利于氨的氧化反应
C.室温下比高温更有利于合成氨中氨的生成
D.用排饱和食盐水来除Cl2中HCl
难度: 简单查看答案及解析
-
在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是
A.pH=3的醋酸跟pH=11的氢氧化钠溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的HNO3跟pH=11的KOH溶液
难度: 简单查看答案及解析
-
下列叙述正确的是
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
难度: 简单查看答案及解析
-
下列说法正确的是
A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2
C.在c(H+)∶c(OH-)=1∶1012的溶液中,Na+、I-、NO3-、SO42-能大量共存
D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-)
难度: 简单查看答案及解析
-
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
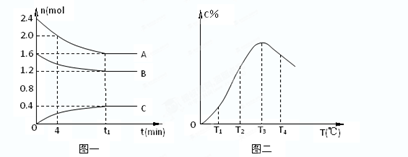
下列分析不正确的是:( )
A.此反应的正反应为吸热反应
B.由T1向T2变化时,V正> V逆
C.增大压强, 平衡向正反应方向移动
D.0~4分钟时,A的速率为0.01mol/(L•min)
难度: 简单查看答案及解析
-
下列叙述错误的是
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液
混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-)
B.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba+)>c (Na+)> c (H+)
C.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
D.向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
难度: 简单查看答案及解析
-
室温下,下列叙述正确的是(溶液体积变化忽略不计)
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.①、④两溶液等体积混合,所得溶液中c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+)
D.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
难度: 简单查看答案及解析
-
下列说法正确的是:
A.已知某温度下纯水中的C(H+)=2×l0-7mol/L,据此无法求出水中C(OH-)
B.常温,Mg(OH)2能溶于氯化铵浓溶液主要原因是NH4+结合OH-使沉淀溶解平衡发生移动
C.已知:
共价键
C—C
C=C
C—H
H—H
键能/kJ·mol-1
348
610
413
436
上表数据可以计算出
(g)+3H2(g)→
(g)的焓变
D.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2/L2
难度: 简单查看答案及解析
-
已知水的电离方程式:H2O
H+ + OH-。下列叙述中,正确的是
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
难度: 简单查看答案及解析
-
在容积不变的密闭容器中,一定条件下发生反应:2A(?)
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为非气态
C.平衡体系中加入少量C,平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是( )
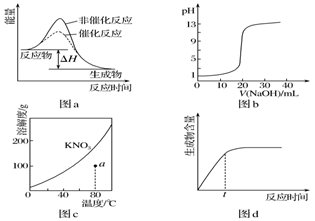
A.图a表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图b表示0.100 0mol·L-1NaOH溶液滴定20.00mL 0.100 0mol·L-1CH3COOH溶液所得到的滴定曲线
C.图c表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图d表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
难度: 简单查看答案及解析
-
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是
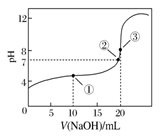
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
难度: 简单查看答案及解析