-
化学与生产、生活等密切相关,下列说法正确的是
A. 纤维素进入人体内会完全水解为葡萄糖从而为人体提供能量
B. 含有食品添加剂的食物对人体均有害
C. 硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用
D. 含氮、磷元素的化合物大量排入江河湖泊中会导致水体富营养化
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述不正确的是
A. 44g乙醛中所含的氧原子数为NA
B. 足量的铜与40mL 10mol/L硝酸反应,生成气体的分子数为0.2NA
C. 14g乙烯中所含的C-H 键数目为2NA
D. 0.1 mol NH3中所含的电子数为NA
难度: 中等查看答案及解析
-
甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法正确的是
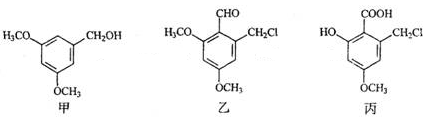
A. 甲、乙均能发生加成反应
B. 甲的一种同分异构体中可能含有苯环和羧基
C. 甲分子中的所有原子可能共平面
D. 用酸性KMnO4溶液可鉴别乙和丙
难度: 中等查看答案及解析
-
由U形管、铁棒、石墨棒、1 L 0.lmol/L CuCl2溶液等组成如图装置,下列说法不正确的是

A. 同时打开K1、K2,铁棒上有紫红色物质析出
B. 只闭合K1,石墨棒上有紫红色物质析出
C. 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体
D. 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解)
难度: 中等查看答案及解析
-
298K时,向体积均为15.0mL、浓度均为1.00moL/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列有关叙述正确的是

A. 两个滴定过程均可选择酚酞作指示剂
B. 曲线a是NaHCO3溶液的滴定曲线
C. 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-)
D. 当V(盐酸)= 15.00mL时,c(Na+)=c(NH4+)
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A. 原子半径:Z>Y
B. 化合物p中只存在离子键
C. 最简单气态氢化物的稳定性:W>X
D. 图示转化关系涉及的反应均为氧化还原反应
难度: 中等查看答案及解析



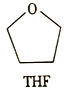
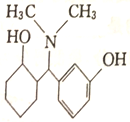 )是一种镇痛和麻醉药物,可由化合物A通过以下路线合成。
)是一种镇痛和麻醉药物,可由化合物A通过以下路线合成。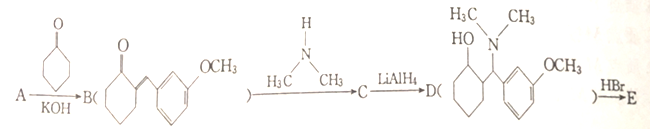
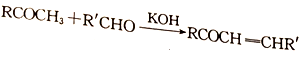

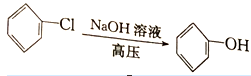
 CH3COOH
CH3COOH 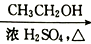 CH3COOCH2CH3)
CH3COOCH2CH3)