-
关于晶体下面说法不正确的是
A. 任何晶体中,若含有阳离子也一定含有阴离子
B. 离子晶体都是化合物
C. 原子晶体中只含有共价键
D. 某晶体固态不导电,熔融状态能导电,则说明该晶体是离子晶体
难度: 中等查看答案及解析
-
现有三种元素的基态原子电子排布式如下①1s22s22p63s23p4;②1s22s22p63s23p3; ③1s22s22p5。则下列有关比较中错误的是
A. 第一电离能:③>②>① B. 原子半径:②>①>③
C. 电负性③>①>② D. 最高正化合价③>②>①
难度: 中等查看答案及解析
-
开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是
A.氮化硅陶瓷是新型无机非金属材料
B.C60属于原子晶体,用于制造纳米材料
C.纤维素乙酸酯属于天然高分子材料
D.单晶硅常用于制造光导纤维
难度: 中等查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.CH4和NH4+是等电子体,键角均为60°
B.NO3-和CO32-是等电子体,均为平面正三角形结构
C.H3O+和PCl3是等电子体,均为三角锥形结构
D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 简单查看答案及解析
-
氰气化学式为(CN)2,结构式为 N≡C—C≡N,性质与卤素相似,叙述正确的是( )
A.在一定条件下可发生加成反应
B.分子中N≡C键的键长大于C—C键的键长
C.分子中含有2个σ键和4个π键
D.不能与氢氧化钠溶液发生反应
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
难度: 简单查看答案及解析
-
配位化合物简称配合物,它的数量巨大,组成和结构形形色色。配合物[Cu(NH3)4](OH)2的中心离子、配体、中心离子的电荷数和配位数分别为( )
A.Cu2+、 OH-、 2+、 2 B.Cu+、 NH3、 1+、 4
C.Cu2+、 NH3、 2+、 4 D.Cu2+、 NH3、 2+、 2
难度: 简单查看答案及解析
-
火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断下列有关说法正确的是( )
A.羰基硫属于非极性分子 B.羰基硫的电子式为
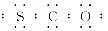
C.羰基硫的沸点比CO2低 D.羰基硫分子中三个原子处于同一直线上
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.NH3、CO、CO2 都是极性分子
B.CH4、CCl4 都是含有极性键的非极性分子
C.HF、HCl、HBr、HI 的稳定性依次增强
D.CS2、H2O、C2H2 都是直线形分子
难度: 简单查看答案及解析
-
下列描述中正确的是( )
A.CS2为V形的极性分子
B.ClO3—的空间构型为平面三角形
C.SF6中有4对完全相同的成键电子对
D.SiF4和SO32—的中心原子均为sp3杂化
难度: 中等查看答案及解析
-
下列晶体分类中正确的是一组是
离子晶体
原子晶体
分子晶体
A
NaOH
Ar
SO2
B
H2SO4
石墨
S
C
CH3COONa
水晶
D
Ba(OH)2
金刚石
玻璃
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关晶体的说法中正确的是( )
A.氯化钾溶于水时离子键未被破坏
B.金属晶体中金属键越强,熔点越高
C.冰融化时分子中共价键发生断裂
D.分子间作用力越大,分子越稳定
难度: 中等查看答案及解析
-
某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )
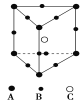
A.1∶4∶2 B.3∶9∶4
C.2∶9∶4 D.3∶8∶4
难度: 简单查看答案及解析
-
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4 B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li D.石墨>金刚石>SiO2>钠
难度: 中等查看答案及解析
-
A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是( )
A.四种元素A、B、C、D分别为O、Ca、Na、Ar
B.元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等
C.元素A、C简单离子的半径大小关系为A<C
D.元素A、C的电负性大小关系为A>C
难度: 中等查看答案及解析
-
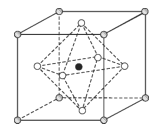
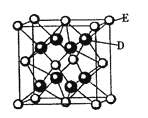
有关晶体的结构如图所示,下列说法中不正确的是( )
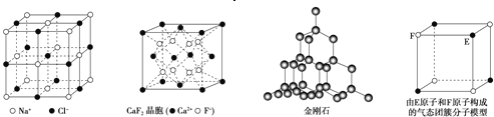
A.在NaCl 晶体中,距Na 最近的Cl 形成正八面体
B.在
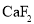 晶体中,每个晶胞平均占有4 个Ca2+
晶体中,每个晶胞平均占有4 个Ca2+C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为EF或FE
难度: 中等查看答案及解析
 2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。