-
在抗击新型冠状脑炎疫情的战役中,化学发挥了关键性的作用,下列说法不正确的是
A.新型冠状病毒的组成元素至少含有C、H、O、N
B.医用酒精可起到杀菌消毒作用,一般医用酒精的浓度为75%
C.部分公共场所用一定浓度的“84”消毒液消毒,其主要成分为NaClO
D.N95 型口罩的核心材料是聚丙烯,聚丙烯是一种天然高分子化合物
难度: 中等查看答案及解析
-
下列化学用语正确的是
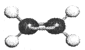
A.乙烯分子的球棍模型:
B.中子数为8的氮原子:
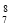 N
NC.NH4Cl 的电子式:
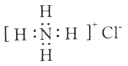
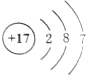
D.Cl- 结构示意图:
难度: 简单查看答案及解析
-
下列设备工作时,将化学能转化为热能的是( )
A.
 硅太阳能电池 B.
硅太阳能电池 B. 锂离子电池
锂离子电池C.
 太阳能集热器 D.
太阳能集热器 D. 燃气灶
燃气灶难度: 简单查看答案及解析
-
下列关于糖类、油脂、蛋白质的叙述中正确的是
A.葡萄糖、麦芽糖互为同分异构体
B.用灼烧的方法无法鉴别蚕丝和人造纤维
C.纤维素在一定条件下能够发生酯化反应
D.利用油脂在酸性条件下水解,可以制肥皂
难度: 中等查看答案及解析
-
下列对于铍(Be)及其化合物性质的预测正确的是
A.碱性: Be(OH)2>Mg(OH)2
B.原子半径: B>Be
C.Be能与冷水剧烈反应
D.相同条件下与酸溶液反应, Li 比 Be 容易
难度: 简单查看答案及解析
-
下列有关物质性质的叙述正确的是
A.锂与氧气反应生成过氧化锂
B.苯与溴水能反应生成溴苯
C.氟气与氢气在暗处能剧烈化合
D.乙醇在常温下遇氧气生成乙醛
难度: 简单查看答案及解析
-
化学反应常伴有颜色变化,下列描述不正确的是
A.将足量乙烯通入酸性高锰酸钾溶液中,紫色溶液逐渐褪色
B.往蔗糖溶液中加入新制氢氧化铜悬浊液并加热,产生砖红色沉淀
C.将混有甲烷和氯气的试管置于光亮处,试管中气体颜色逐渐变浅
D.向鸡蛋清溶液中滴入几滴浓硝酸, 微热,溶液颜色变黄
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列有关叙述正确的是
A.标准状况下,22.4L CCl4中所含C-Cl键的数目为4NA
B.l mol 苯中含碳碳双键的数目3NA
C.标准状况下,2.24LC2H4中所含共用电子对的数目为0.6NA
D.密闭容器中,l mol N2和3mol H2充分反应, 可生成NH3分子的数目为2NA
难度: 简单查看答案及解析
-
假设某化学反应的反应过程如图所示,观察分析,符合图中变化的化学反应为( )
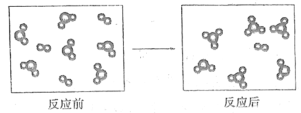
A.
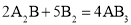 B.
B.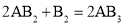
C.
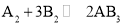 D.
D.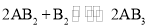
难度: 简单查看答案及解析
-
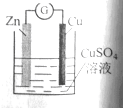
氢氧燃料电池已用于航天飞机,以 30%KOH 溶液为电解质溶液的这种电池其工作原理如图所示。关于该燃料电池的说法正确的是
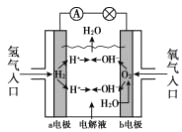
A.该电池总方程式为2H2 +O2 = 2H2O
B.该电池工作时,热能转化为电能
C.电流从a 电极经外电路流向 b 电极
D.燃料电池的能量转化率可达100%
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.钾与水的反应:2K + 2H2O= 2K++2OH- + H2↑
B.醋酸溶液与石灰石反应:2H++CaCO3=Ca2++CO2↑+ H2O
C.硫酸溶液和氢氧化钡溶液反应:Ba2+ + H++OH-+
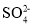 =BaSO4↓+H2O
=BaSO4↓+H2OD.硫酸酸化含Br- 和BrO3-的溶液得到浓度较大的溴水:Br-+
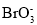 +6H+=Br2+3H2O
+6H+=Br2+3H2O难度: 简单查看答案及解析
-
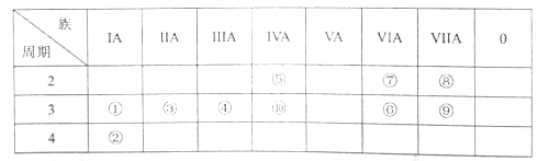
下列图示所对应的叙述正确的是
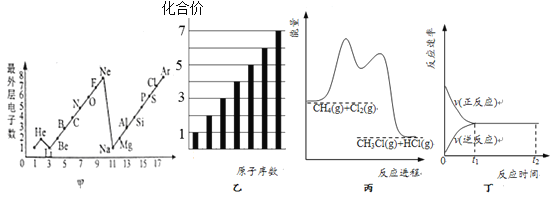
A.图甲表示短周期元素的最外层电子数随原子序数的变化情况
B.图乙表示第二周期主族元素最高化合价随原子序数的变化情况
C.图丙表示 CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D.图丁表示,某一可逆反应的化学反应速率随时间的变化,t1 ~t2时间:v正= v逆= 0
难度: 中等查看答案及解析
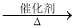 2CH2=CH-COOH + 2H2O,下列说法正确的是
2CH2=CH-COOH + 2H2O,下列说法正确的是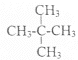 和
和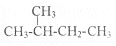 e.
e.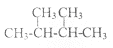 和
和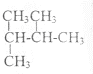
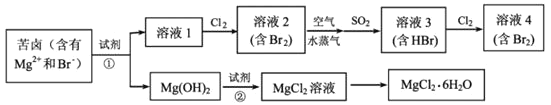
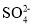 ,则该反应中消耗的n(SO2):n(Br2)= __;反应②的离子方程式为 __________。
,则该反应中消耗的n(SO2):n(Br2)= __;反应②的离子方程式为 __________。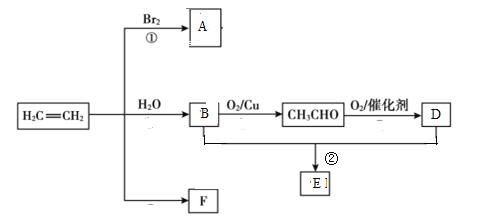
 2CH3COOH
2CH3COOH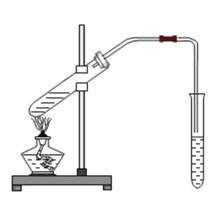
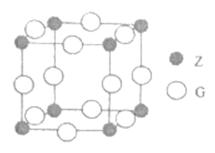
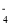 +6H+→2Mn2++10CO2↑+8H2O
+6H+→2Mn2++10CO2↑+8H2O