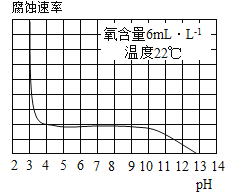
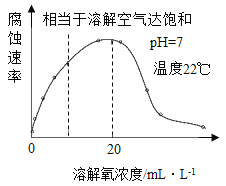
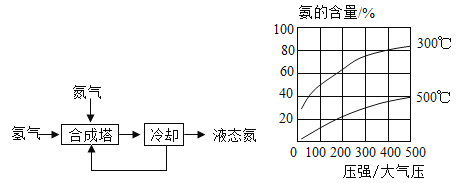
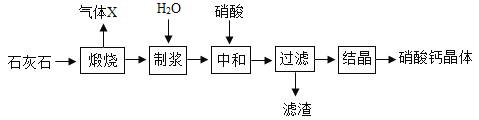
-
“垃圾分类工作就是新时尚”。废旧报纸应投入的垃圾箱是
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
下列物质属于氧化物的是
A.O3 B.SO3 C.NaOH D.K2SO4
难度: 简单查看答案及解析
-
下列变化属于化学变化的是
A.干冰升华
B.衣服晾干
C.冰雪融化
D.食物腐败
难度: 简单查看答案及解析
-
下列物质由离子构成的是( )
A.铜
B.水
C.氯化钠
D.氖气
难度: 简单查看答案及解析
-
四氯化钛(TiCl4)可用于冶炼金属钛。四氯化钛中钛元素的化合价为
A.+4 B.-4 C.0 D.-1
难度: 简单查看答案及解析
-
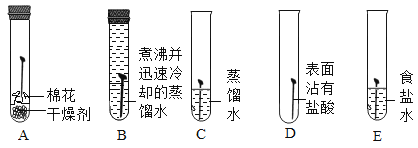
下列实验操作图示正确的是
A.加热液体
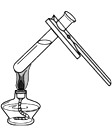 B.测定pH
B.测定pH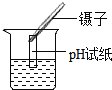
C.滴加液体
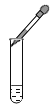 D.检查气密性
D.检查气密性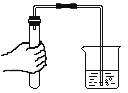
难度: 简单查看答案及解析
-
下列常见材料中,属于合成材料的是
A.陶瓷
B.焊锡
C.塑料
D.钢筋混凝土
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.五氧化二磷:P2O5
B.银元素:AG
C.2个镁离子:2Mg+2
D.8个硫原子:S8
难度: 简单查看答案及解析
-
工业用反应
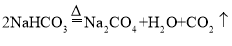 来制备纯碱,该反应属于
来制备纯碱,该反应属于A.分解反应
B.化合反应
C.置换反应
D.复分解反应
难度: 简单查看答案及解析
-
下列有关氧气的说法中,不正确的是
A.氧气可供给呼吸
B.鱼类能在水中生存,说明氧气易溶于水
C.植物的光合作用是空气中氧气的主要来源
D.焊接或切割金属时使用纯氧代替空气以获得更高的温度
难度: 简单查看答案及解析
-
某净水装置如图所示。下列说法正确的是
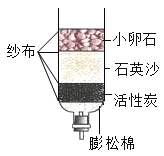
A.该装置能对水进行杀菌消毒
B.该装置能除去水中的颜色和异味
C.硬水经过该装置后可转化为软水
D.自来水经过该装置后可得蒸馏水
难度: 简单查看答案及解析
-
下列指定反应的化学方程式正确的是( )
A.镁条燃烧:
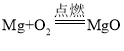
B.铜绿分解:
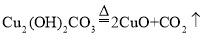
C.氨水中和硫酸:
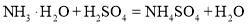
D.酒精完全燃烧:
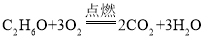
难度: 简单查看答案及解析
-
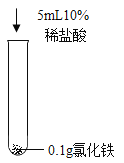
利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
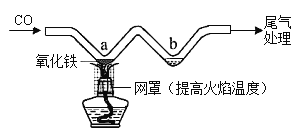
A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
难度: 简单查看答案及解析
-
下列物质的性质与用途具有对应关系的是
A.天然气难溶于水,可用作燃料
B.碳酸氢铵受热易分解,可用作化肥
C.石墨有导电性,可用于生产铅笔芯
D.小苏打能与盐酸反应,可用于治疗胃酸过多
难度: 简单查看答案及解析
-
下列关于溶液的说法正确的是( )
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
难度: 简单查看答案及解析
-
下列各组离子在溶液中能大量共存的是( )
A.NH
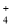 、SO
、SO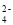 、NO
、NO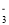
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
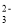
难度: 简单查看答案及解析
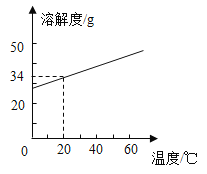
-
K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是( )
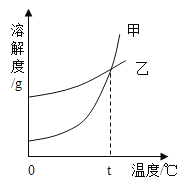
温度/℃
20
40
50
60
80
溶解度/g
K2CO3
110
117
121
126
139
KNO3
31.6
63.9
85.5
110
169
A.K2CO3的溶解度大于KNO3
B.乙代表K2CO3的溶解度曲线
C.t应在50℃~60℃之间
D.40℃时,100gKNO3饱和溶液中含63.9gKNO3
难度: 简单查看答案及解析
-
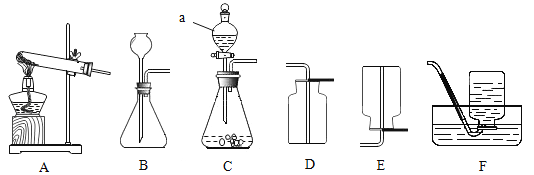
下列实验方案不能达到目的的是
A.鉴别:用熟石灰鉴别NH4Cl固体和NH4NO3固体
B.除杂:用浓硫酸除去O2中混有的少量水蒸气
C.检验:用高锰酸钾溶液检验CO2中是否混有SO2
D.制备:实验室用锌粒和稀硫酸制备少量H2
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化不能实现的是( )
A.
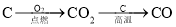
B.
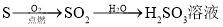
C.
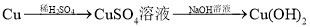
D.
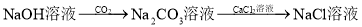
难度: 中等查看答案及解析
-
用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是
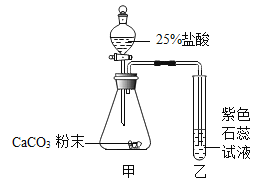
A.甲中逸出的气体只含CO2
B.乙中液体变红,证明CO2能与水反应
C.加热后红色不褪去,说明碳酸受热不分解
D.欲达到实验目的,可将盐酸改为稀硫酸
难度: 中等查看答案及解析
 )
)
 )
)
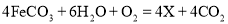 ,则X的化学式为___________。
,则X的化学式为___________。