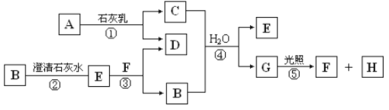
-
下列叙述正确的是( )
A. 硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价) 用氧化物形式表示:BaO·CuO·SiO2
B. 向氯化铁溶液中加入氢氧化钠溶液来制备Fe(OH)3胶体
C. 用丁达尔现象实验可以区分食盐水和淀粉溶液
D. 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物
难度: 简单查看答案及解析
-
A、B、C、D都是短周期元素,原子半径D>C>A>B ,已知A、B同周期相邻,A、C处于同一主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的5倍,下列说法正确的是
A.A、C两元素可能处于第ⅢA族或第ⅥA族
B.D、B两元素组成的离子化合物阴阳离子之比为2:1或1:1
C.三种元素的简单离子的半径大小顺序为:C>D>B
D.D、C、B三种元素组成的化合物的化学式为D3CB4
难度: 中等查看答案及解析
-
下列关于元素周期表的说法正确的是( )
A.元素周期表有7个周期,8个主族 B.元素周期表有18个纵行,共16个族
C.短周期元素中可能有副族元素 D.元素周期表中的过渡元素就是副族元素
难度: 简单查看答案及解析
-
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是
A.碘升华 B.Cl2 溶于水 C.氯化钠受热熔化 D.酒精溶解于水
难度: 简单查看答案及解析
-
下列实验中,不能观察到明显现象的是
A.把氯气通入到FeSO4溶液中 B.把一段打磨过的铝条放入少量冷水中
C.向饱和Na2CO3溶液通入足量的CO2 D.把溴水滴加到KI淀粉溶液中
难度: 中等查看答案及解析
-
下列叙述正确的是
A.常温常压下,8gO2含有4NA个电子
B.0.2g超重水(T216O)中含有的质子数、中子数和电子数均为0.1NA
C.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和等于 0.2NA
D.标准状况下,11.2LCCl4中含分子数为0.5 NA
难度: 简单查看答案及解析
-
氯化钠是一种重要的化工原料。下列表述中正确的是
A.NaCl的电子式为
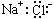
B.电解熔融氯化钠可得到氯气和金属钠
C.23Na37Cl中质子数和中子数之比是8:7
D.由NaCl制备纯碱时发生了氧化还原反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下铁与浓硫酸不反应 B.钠与氧气反应的产物与反应条件无关
C.漂白粉暴露在空气中会变质 D.SiO2属于酸性氧化物,可与水反应得硅酸
难度: 中等查看答案及解析
-
化学与生产、生活、科技等密切相关。下列说法正确的是
A.“华为P30 pro”手机中麒麟芯片的主要成分是二氧化硅
B.氯气和CH4分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
C.海水中加入明矾可以使海水淡化
D.Al(OH)3具有弱碱性,可用于制作胃酸中和剂
难度: 简单查看答案及解析
-
科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第七周期第ⅣA族,称为类铅。关于它的性质,预测错误的是( )
A.它的最外层电子数为4
B.它的失电子能力比铅强
C.它具有+2、+4价
D.它的最高价氧化物对应的水化物是强酸
难度: 中等查看答案及解析
-
NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体是
A.NH3 B.H2O C.O2 D.O2和NH3
难度: 简单查看答案及解析
-
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是① NO和NO2,② NO2和O2,③ NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
难度: 中等查看答案及解析
-
张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列关于
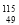 In的说法中,错误的是 ( )
In的说法中,错误的是 ( )A.
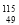 In原子核外有49个电子 B.
In原子核外有49个电子 B.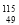 In原子核内有49个中子
In原子核内有49个中子C.
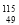 In原子的质量数为115 D.
In原子的质量数为115 D.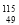 In是In元素的一种核素
In是In元素的一种核素难度: 简单查看答案及解析
-
下列过程属于人工固氮的是( )
A.分离液态空气制氮气 B.闪电时N2转化为NO
C.合成氨 D.豆科作物根瘤菌将N2转化为NH3
难度: 简单查看答案及解析
-
下列有关说法不正确的是 ( )
A. pH小于5.6的雨水称为酸雨
B. 分散质粒子直径介于1~100nm之间的分散系称为胶体
C. 王水是浓硝酸和浓盐酸按物质的量之比1:3组成的混合物
D. 光导纤维的主要成分是二氧化硅,太阳能光电板的主要原料是硅晶体
难度: 简单查看答案及解析