-
化学与生产、生活等密切相关。下列说法错误的是
A.“光化学烟雾”的形成与氮氧化合物有关
B.“玉不琢不成器”、“百炼方能成钢”均发生化学变化
C.绿色化学要求从源头上消除或减少生产活动对环境的污染
D.明矾和漂白粉可用于自来水的净化,但两者的作用原理不相同
难度: 中等查看答案及解析
-
下列有关元素与物质分类说法正确的是
A.Na2O2、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
B.根据溶液导电能力强弱,将电解质分为强电解质和弱电解质
C.依据丁达尔效应可将分散系分为溶液、胶体与浊液
D.向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热即制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是
A.1molCl2参加反应转移电子数一定为2NA
B.100mL0.1mol·L-1的氨水中含有0.01NA个
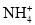
C.标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA
D.25℃,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-5NA
难度: 中等查看答案及解析
-
下列有关溶液中离子反应或离子共存说法正确的是
A.向小苏打溶液中滴加少量澄清石灰水:Ca2++2OH-+2
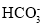 =CaCO3↓+
=CaCO3↓+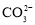 +2H2O
+2H2OB.无色溶液中可能大量存在Al3+、
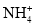 、Cl-、S2-
、Cl-、S2-C.溴化亚铁溶液中通入少量氯气:2Br-+Cl2=Br2+2Cl-
D.水电离出c(H+)=1×10-12mol·L-1的溶液中能大量存在K+、I-、Mg2+、
难度: 中等查看答案及解析
-
下列实验操作或实验仪器使用错误的是
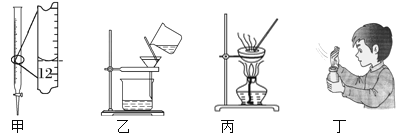
A.甲图液面读数为11.80mL
B.用装置乙除去粗盐溶液中的不溶物
C.用装置丙蒸发FeCl3溶液制取FeCl3晶体
D.丁图是闻气体气味的操作
难度: 简单查看答案及解析
-
已知甲为带有活塞的密闭容器(活塞可以自由滑动且质量忽略不计)、乙为恒容容器,一定温度下充入等量NO2气体,起始时体积相同,发生反应2NO2(g)⇌N2O4(g),一段时间后相继达到平衡状态,下列说法中正确的是
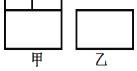
A.达到平衡所需时间:甲<乙
B.将乙升高温度,气体颜色加深,则此反应为吸热反应
C.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
D.恒温时向乙中充入稀有气体,压强增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列关于溶液的说法中错误的是
A.常温下,NH4Cl溶液加水稀释后,n(H+)与n(OH-)的乘积变大
B.NaF和氢氟酸的混合液中存在:c(Na+)>c(F-)>c(H+)>c(OH-)
C.25℃测得0.1mol·L-1醋酸钠溶液pH=8.9,说明醋酸是弱电解质
D.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:c(
 )+c(OH-)=c(H2CO3)+c(H+)+0.05mol·L-1
)+c(OH-)=c(H2CO3)+c(H+)+0.05mol·L-1难度: 困难查看答案及解析
-
下列实验操作能达到实验目的的是
目的
操作
A
测定NaClO溶液的pH
取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比
B
证明Na2CO3溶液中存在水解平衡
向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化
C
验证Ksp(AgCl)>Ksp(AgI)
取2mL0.1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀
D
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25℃时,下列4种盐的溶度积常数(Ksp)分别是:
Ag2SO4(白色)
Ag2S(黑色)
FeS(黑色)
MnS(肉色)
1.4×10-5mol3·L-3
6.3×10-50mol3·L-3
3.3×10-18mol2·L-2
2.5×10-13mol2·L-2
结合相关数据分析,下列说法错误的是
A.除去某溶液中的Ag+用Na2S溶液比Na2SO4溶液效果好
B.25℃时,MnS的溶解度大于FeS的溶解度
C.向少量FeS悬浊液中加入足量饱和MnCl2溶液,沉淀颜色会由黑色变为肉色
D.向Ag2S(s)⇌2Ag+(aq)+S2-(aq)平衡体系中加入少量Na2S固体,溶液中c(Ag+)不变
难度: 中等查看答案及解析
-
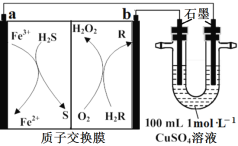
如图是家庭自制含氯消毒剂装置(C1和C2为铅笔芯)。接通电源:C1周围产生细小气泡,C2周围无明显现象;持续通电一段时间,当C2周围产生细小气泡立即停止通电。下列说法错误的是

A.C1周围产生气泡的原因是2H2O+2e-=H2↑+2OH-
B.C2与适配器输出的正极相连
C.持续通电一段时间后,C2周围产生气泡主要成分为Cl2
D.制含氯消毒剂的总反应为NaCl+H2O
 NaClO+H2↑
NaClO+H2↑难度: 中等查看答案及解析
-
锰酸锂(LiMn2O4)是最早制得的具有三维锂离子通道的正极材料。以MnSO4和LiFePO4为原料制备锰酸锂的流程如图:
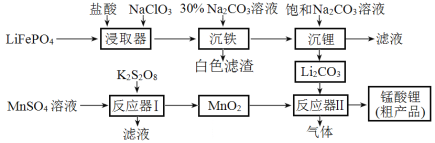
下列说法错误的是
A.NaClO3的作用是将二价铁氧化为三价铁
B.“沉铁”过程所得滤渣的主要成分是FePO4
C.反应器Ⅱ中产生的气体是CO2
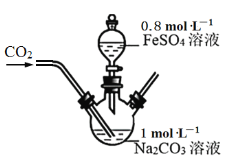
D.已知K2S2O8中S的化合价为+6价,则
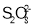 中存在“—O—O—”键
中存在“—O—O—”键难度: 困难查看答案及解析
-
工业用CO2和H2合成乙醇:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g)。保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比m[
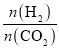 ]的关系如图所示。下列说法正确的是
]的关系如图所示。下列说法正确的是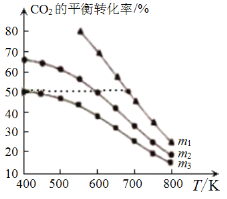
A.△H>0
B.m1<m2<m3
C.若m3=3,则400K时H2的平衡转化率为50%
D.投料比m=1时,容器内CO2的体积分数不再改变则反应达到平衡状态
难度: 中等查看答案及解析
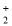 为淡黄色,VO
为淡黄色,VO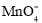 >Cl2
>Cl2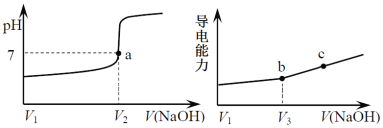
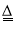 NaClO3+5NaCl+3H2O,并设计如图制备NaClO溶液的装置:
NaClO3+5NaCl+3H2O,并设计如图制备NaClO溶液的装置: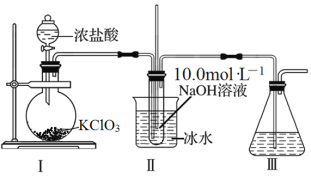
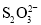 =
=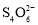 +2I-),滴定时应将Na2S2O3溶液加入________(填“酸式”或“碱式”)滴定管中。当溶液________,即为滴定终点;三次滴定平均消耗20.00mL的Na2S2O3溶液,则乳酸亚铁的质量分数为________%(保留1位小数)。
+2I-),滴定时应将Na2S2O3溶液加入________(填“酸式”或“碱式”)滴定管中。当溶液________,即为滴定终点;三次滴定平均消耗20.00mL的Na2S2O3溶液,则乳酸亚铁的质量分数为________%(保留1位小数)。 2NH3(g) △H=-92kJ·mol-1,工业合成氨温度选择700K的原因是________。
2NH3(g) △H=-92kJ·mol-1,工业合成氨温度选择700K的原因是________。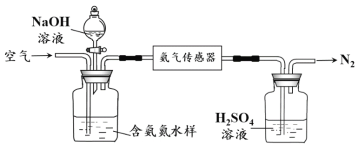
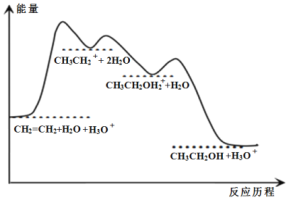
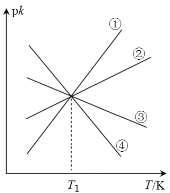
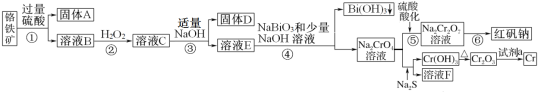
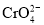 。
。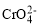 +2H+⇌
+2H+⇌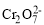 +H2O
+H2O