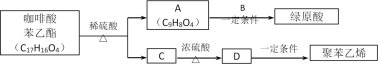-
下列说法正确的是
A. 光导纤维、合成纤维和人造纤维都是有机高分子材料
B. PM2.5是指空气中氮氧化物和硫氢化物的总和
C. “青蒿一渥,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学反应
D. 合金拓展了金属材料的使用范围,合金也可能含有非金属元素
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A. 某钾盐K2A 的水溶液显碱性,其原因是:A2-+2H2O
 H2A+2OH-
H2A+2OH-B. 碳酸氢根离子的电离:HCO3—+H2O
 CO32—+ H3O+
CO32—+ H3O+C. 碳酸氢铵溶液与足量的NaOH溶液混合加热:NH
 +OH-
+OH- NH3↑+ H2O
NH3↑+ H2OD. 在Ba(HCO3)2溶液中逐滴滴入NaHSO4 溶液至Ba2+恰好完全沉淀时: Ba2++2HCO3-+2H++SO42-
 BaSO4↓+2CO2↑+2H2O
BaSO4↓+2CO2↑+2H2O难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 常温常压下,将0.1mol的NO与0.1molO2混合,则混合气体中含有原子数为0.4NA
B. 常温常压下,3g乙烷中所含极性共价键数0.7NA
C. 6g
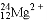 中所含中子数为3 NA
中所含中子数为3 NAD. 标准状况下,2.24 L Cl2与0.1molH2混合,则混合气体中含有分子数为0.2NA
难度: 中等查看答案及解析
-
下表中的实验操作能达到实验目的的是
选项
实验操作及现象
实验目的
A
将浓H2SO4与乙醇按3:1的比例混合后,加入到
有沸石的装置中,加热到约170℃,把产生的气
体直接通入酸性KMnO4溶液中
检验乙烯可使酸性
KMnO4溶液褪色
B
某溶液中先滴加氯水,再滴加KSCN溶液,呈红色
该溶液中定含Fe2+
C
某溶液中滴入Ba(NO3)2溶液,产生沉淀,再加足量的稀盐酸,仍有沉淀
检验该溶液有SO42-
D
常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH
证明相同条件下,在水中HCl电离度大于CH3COOH
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分子式为C7H6O2,含有苯环,且能发生银镜反应的同分异构体有
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
难度: 困难查看答案及解析
-
异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是
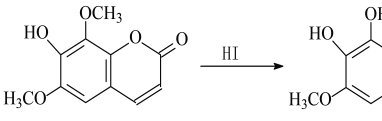
A. 异秦皮啶分子式为C11H10O5
B. 异秦皮啶与秦皮素互为同系物
C. 鉴别异秦皮啶与秦皮素可用FeCl3溶液
D. 1 mol秦皮素最多可与3 mol NaOH反应
难度: 中等查看答案及解析
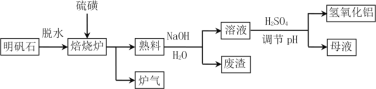
 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。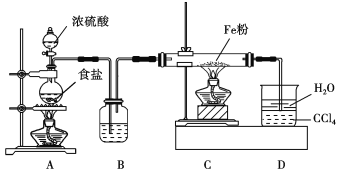
 2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)
2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)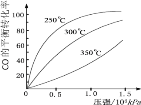
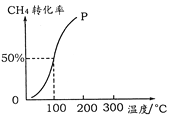
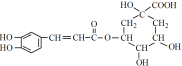 是一种抗氧化药物,存在下图转化关系。
是一种抗氧化药物,存在下图转化关系。