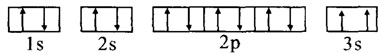
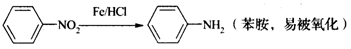
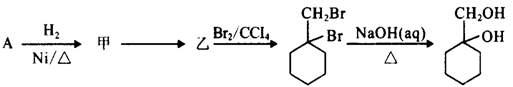
-
化学与生产、生活、社会密切相关,下列有关说法中不正确的是 ( )
A.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
B.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯
C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物
D.针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表 ( )
元素代号
X
Y
Z
M
N
P
原子半径/nm
0.186
0.143
0.075
0.074
0.152
0.099
元素的主要化合价
+1
+3
+5、-3
-2
+1
+7、-1
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
A.X、N元素的金属性:X>N
B.Y、M元素形成的离子化合物是工业冶炼Y的原料
C.X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子
D.标准状况下1L 1mol·L-1的YP3溶液中含有NA个Y3+离子
难度: 简单查看答案及解析
-
下列化学过程及其表述正确的是 ( )
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.由水电离的c(H+)为10-3 mol·L-1的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存
C.向含有1molKAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
难度: 简单查看答案及解析
-
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(Ⅰ)所示。保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
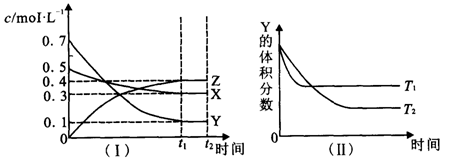
A.图(Ⅱ)中T1>T2,则正反应是吸热反应
B.t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大
D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol·L-1X、0.4 mol·L-1 Y、0.2mol/LZ保持其他
条件不变,达到平衡时z的浓度为0.4 mol·L-1
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
①分子组成为C4H10O的醇有4种
②1molCH≡CH与足量的HCl加成后再与Cl2发生取代反应,反应完全共需4molCl2
③(CH3)3CCH2CH3的一氯代物有3种
④石油裂解和油脂皂化都是由高分子生成小分子的过程
A.①②③④全正确 B.只有①②③正确
C.只有①③正确 D.只有①③④正确
难度: 简单查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是 ( )
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.乙醇分子中含有氢氧根,一定条件下能与盐酸发生中和反应
C.苯和硝酸反应生成硝基苯,乙酸和乙醇反应生成乙酸乙酯,二者反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 简单查看答案及解析
-
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是 ( )
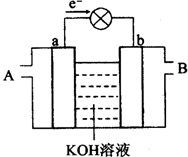
A.A处通入空气,B处通入水煤气
B.a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C.a电极发生还原反应,b电极发生氧化反应
D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24 L
难度: 简单查看答案及解析