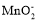-
在宾馆、办公楼等公共场所,常使用一种电离式烟雾报警器,其主体是一个放有镅-242(
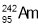 )放射源的电离室。
)放射源的电离室。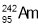 原子核内中子数与核外电子数之差是
原子核内中子数与核外电子数之差是A.52 B.147 C.95 D.51
难度: 简单查看答案及解析
-
下列关于元素周期表叙述不正确的是( )
A.元素周期表有18个纵行,16个族
B.副族元素没有非金属元素
C.短周期元素的最高化合价在数值上都等于该元素所属的族序数
D.最外层电子数是3的元素一定属于ⅢA族
难度: 简单查看答案及解析
-
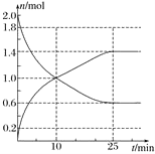
2SO2(g)+O2(g)⇌2SO3(g)的反应中,经过一段时间后,SO3的浓度增加了1.8mol·L-1,此时间内用O2表示的平均速率为0.45mol·L-1·s-1,则这段时间是( )
A.1s B.0.44s C.2s D.1.33s
难度: 中等查看答案及解析
-
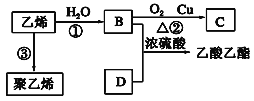
常温常压下,取下列有机物各1mol,分别在足量的氧气中燃烧,消耗氧气相同的是( )
A.乙醇和乙酸 B.乙炔和苯 C.乙烯和乙醇 D.甲烷和甲醇
难度: 简单查看答案及解析
-
糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A.植物油不能发生水解反应
B.淀粉和纤维素化学式都是(C6H10O5)n,所以淀粉和纤维素互为同分异构体
C.葡萄糖能发生氧化反应和水解反应
D.蛋白质遇到高温条件失去生理活性
难度: 简单查看答案及解析
-
已知X2+、Y+、Z2-、W-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是
A.原子半径:X>Y>Z>W
B.原子序数:Y>X>Z>W
C.原子最外层电子数:W>Z>X>Y
D.还原性:Y>X,W->Z2-
难度: 简单查看答案及解析
-
短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )
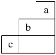
A.a的氢化物很稳定
B.b是一种活泼的非金属元素
C.b元素的最高化合价为+7价
D.c的氧化物的水化物是一种强酸
难度: 简单查看答案及解析
-
一定条件下,在体积一定的密闭容器中加入1molN2和3molH2发生反应:N2+3H2
 2NH3(正反应是放热反应)。下列有关说法正确的是( )
2NH3(正反应是放热反应)。下列有关说法正确的是( )A.向该容器充入氦气,反应速率加快
B.1molN2和3molH2的总能量低于2molNH3的总能量
C.达到化学反应限度时,生成2molNH3
D.到达平衡时氨气浓度不变
难度: 简单查看答案及解析
-
PX是纺织工业的基础原料,其结构简式如图所示,下列说法不正确的是( )
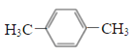
A.PX的分子式为C8H10
B.PX的一氯代物有2种
C.PX与乙苯互为同分异构体
D.PX分子中所有原子都处于同一平面
难度: 简单查看答案及解析
-
下列条件一定能使反应速率加快的是( )
①增加反应物的浓度②升高温度③缩小反应容器的体积④加入生成物⑤加入MnO2
A.全部 B.①②⑤ C.①② D.②⑤
难度: 中等查看答案及解析
-
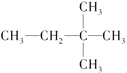
下列烷烃在光照下与氯气反应,只生成三种一氯代烃的是( )
A.
 B.
B.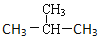
C.
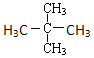 D.
D.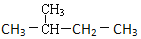
难度: 简单查看答案及解析
-
在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃不可能是( )
A.CH4和C2H4 B.C2H2和C2H6 C.C2H4和C2H6 D.C2H2和C3H6
难度: 简单查看答案及解析
-
下列各组物质的性质由强到弱的顺序排列正确的是( )
A.酸性:HClO>H2SO4>H3PO4
B.氢化物稳定性:HF>H2O>H2S
C.碱性:NaOH>KOH>Ca(OH)2
D.沸点:HI>HBr>HCl>HF
难度: 简单查看答案及解析
-
用惰性电极电解物质的量浓度相同、体积比为1:1的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O
 2Cu+4H++O2↑
2Cu+4H++O2↑②Cu2++2Cl-
 Cu+Cl2↑
Cu+Cl2↑③2Cl-+2H2O
 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-④2H2O
 2H2↑+O2↑
2H2↑+O2↑A.①②③ B.①②④ C.②③④ D.②④
难度: 中等查看答案及解析
-
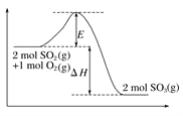
如图所示,ΔE1=393.5kJ,ΔE2=395.4kJ,下列说法不正确的是( )
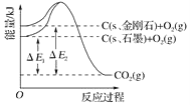
A.1mol石墨完全转化为金刚石需吸收1.9kJ热量
B.石墨和金刚石之间的转化是化学变化
C.石墨的稳定性强于金刚石
D.1mol金刚石具有的总能量高于1molCO2的总能量
难度: 中等查看答案及解析
-
1mol白磷转化为红磷时放出18.39kJ热量,已知:P4(白磷,s)+5O2(g)=2P2O5(s) ΔH=akJ·mol-1;4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=bkJ·mol-1,则a和b的关系是
A.a>b B.a=b C.a<b D.无法确定
难度: 简单查看答案及解析
-
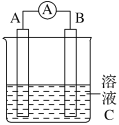
下列实验现象预测不正确的是( )
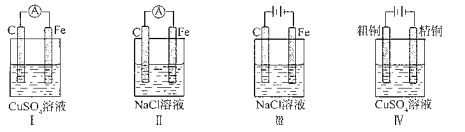
A.实验I:电流表A指针偏转,碳棒上有红色固体析出
B.实验II:电流表A指针偏转,碳棒上有无色气体产生
C.实验Ⅲ:碳棒上有黄绿色气体产生,铁极上有无色气体产生
D.实验IV:可实现粗铜的提纯
难度: 简单查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中不正确的是( )
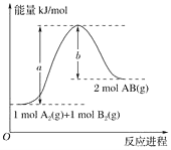
A.每生成2分子AB(g)吸收bkJ热量
B.该反应热ΔH=+(a-b)kJ/mol
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1molA-A和1molB-B键,吸收akJ能量
难度: 简单查看答案及解析
-
在一定温度下的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③混合气体的相对分子质量不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成nmolD,同时生成2nmolA
⑥单位时间内生成nmolC,同时生成nmolD
A.①②⑤ B.②③⑤ C.②③⑥ D.①③⑥
难度: 简单查看答案及解析
-
反应4A(s)+3B(g)⇌4C(g)+D(g),经2minB的浓度减少0.6mol·L-1,对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4mol·L-1·min-1
B.在这2min内用A和C表示的反应速率的值都是相同的
C.在2min末时的反应速率,用反应物B来表示是0.3mol·L-1·min-1
D.B、C的速率关系:4v(B)=3v(C)
难度: 简单查看答案及解析
-
“类推”是常用的学习方法,下列类推的结论中,正确的是( )
A.存在离子键的化合物是离子化合物,则存在共价键的化合物是共价化合物
B.Cl2+H2O=HCl+HClO,所以F2+H2O=HF+HFO
C.ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4,则VA族元素氢化物沸点顺序是AsH3>PH3>NH3
D.第二周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序是HCl>H2S>PH3
难度: 中等查看答案及解析
-
以下说法正确的是( )
A.石墨与金刚石互为同分异构体
B.氢键属于化学键
C.金属元素和非金属元素形成的化合物在熔融状态下一定能导电
D.Na2O2晶体中,阴、阳离子个数比为1:2
难度: 简单查看答案及解析
-
20世纪80年代后,人们发现和证实了一种新的含碳物质,它们是由一系列偶数个碳原子组成的分子,其中C60最具代表性。图中所示为n个C60连接而成的物质X。下列有关说法正确的是( )
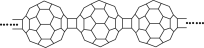
A.X易溶于水,可以与氧气反应生成CO2
B.该物质是一种新型的化合物
C.X是碳的一种同素异形体
D.X的摩尔质量为720n
难度: 简单查看答案及解析