-
要从苯酚的乙醇溶液中回收苯酚,有下列操作;①蒸馏;②过滤;③静置分液;④加入足量金属钠;⑤通入过量CO2;⑥加入足量NaOH溶液;⑦加入足量FeCl3溶液;⑧加入乙酸与浓H2SO4混合加热,合理的步骤是
A.④⑤③ B.⑥①⑤③ C.⑧① D.⑧②⑤③
难度: 中等查看答案及解析
-
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的顺序组合正确的是( )
纯净物
混合物
强电解质
弱电解质
非电解质
A
盐酸
水煤气
硫酸
醋酸
HD
B
胆矾
石灰水
硫酸钡
HNO2
NH3
C
火碱
蔗糖溶液
氯化钠
氨水
三氧化硫
D
冰醋酸
福尔马林
苛性钾
碘化氢
乙醇
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列过程属于化学变化的是:①白色的硫酸铜粉末久置于空气中变成蓝色;②福尔马林用来浸制标本;③同素异形体之间的互变;④同分异构体之间的互变;⑤蜂蚁叮咬处涂稀氨水或小苏打溶液可减轻痛苦;⑥核裂变
A.只有②③④⑤ B.只有③④⑤ C.只有①②③④⑤ D.全部
难度: 简单查看答案及解析
-
下列说法正确的是:
A.按系统命名法,化合物
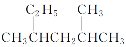 的名称为2-甲基-4-乙基戊烷
的名称为2-甲基-4-乙基戊烷B.苯酚、水杨酸(
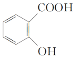 )和苯甲酸都是同系物
)和苯甲酸都是同系物C.等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少
D.三硝基甲苯的分子式为C7H3N3O6
难度: 简单查看答案及解析
-
某同学向c(FeCl3)=0.2 mol·L-1、c(FeCl2)=0.1 mol·L-1的混合溶液中滴加稀NaOH溶液,意外得到一种黑色分散系,经查阅资料后得知,该分散系中分散质粒子是直径介于1~100 nm之间的金属氧化物,下列有关说法中错误的是:
A.该分散系可产生丁达尔现象
B.加入NaOH时发生的反应为Fe2++2Fe3++8OH-===Fe3O4+4H2O
C.若在电极作用下,阴极附近分散系黑色变深,则说明该分散系分散质带正电
D.可用过滤的方法将分散剂与分散质分离开
难度: 中等查看答案及解析
-
柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的分析正确的是( )
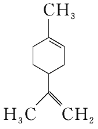
A.它的一氯代物有6种
B.它的分子中所有的碳原子一定在同一平面上
C.它和丁基苯
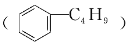 互为同分异构体
互为同分异构体D.一定条件下,它分别可以发生加成、取代、氧化、还原等反应
难度: 困难查看答案及解析
-
下列对分子的性质的解释中,不正确的是:
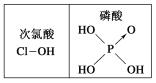
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸
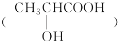 有一对对映异构体,因为其分子中含有一个手性碳原子
有一对对映异构体,因为其分子中含有一个手性碳原子C.水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键
D.由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.工业上用电解法制备烧碱:
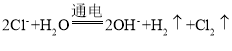
B.用食醋除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2 O+ CO2↑
C.NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-
 H2O+NH3↑
H2O+NH3↑D.铜溶于硫酸酸化的过氧化氢溶液:Cu+2H++H2O2=Cu2++2H2 O
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是:
A.向含有FeI2的溶液中通入适量氯气,当有1 mol Fe2+被氧化时,该反应转移电子数目为3NA
B.0.1 mol丙烯酸(CH2=CH—COOH)中含有双键数目为0.1NA
C.含0.1 mol NH4HSO4的溶液中,阳离子数目略小于0.2NA
D.2.0 g H2
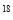 O与D2O的混合物中所含中子数为NA
O与D2O的混合物中所含中子数为NA难度: 中等查看答案及解析
-
化学与人类的生活,生产密切相关,下列说法中正确的是
A. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
B. 埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同
C. 纯碱是属于碱类、谷氨酸钠(C5H8NO4Na,味精)属于盐类
D. 压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的清洁燃料
难度: 中等查看答案及解析
-
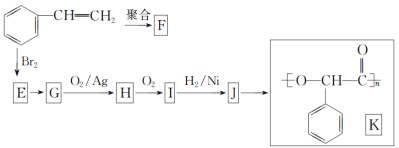
某同学设计了由乙醇合成乙二醇的路线如下。下列说法正确的是:


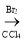

A.步骤①的反应类型是水解反应
B.X可以发生加成反应
C.步骤②需要在氢氧化钠醇溶液中反应
D.等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN −、Cl –
B.
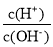 =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO 、NO
、NO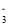
C.
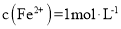 的溶液中: K+、NH
的溶液中: K+、NH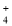 、MnO
、MnO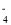 、SO
、SO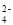
D.能使甲基橙变红的溶液中: Na+、NH
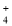 、SO
、SO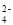 、HCO
、HCO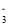
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
①原子晶体中只存在非极性共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④干冰升华时,分子内共价键会发生断裂
⑤晶格能由大到小顺序:NaF>NaCl>NaBr>NaI
⑥分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
⑦分子晶体中分子间作用力越大,分子越稳定
A. ①②③⑥ B. ①②④ C. ③⑤⑥⑦ D. ③⑤
难度: 中等查看答案及解析
-
以下有关元素性质的说法不正确的是
A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是①
B.具有下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③
C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl,元素的电负性随原子序数增大而递增的是④
D.某元素气态基态离子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+
难度: 中等查看答案及解析
-
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
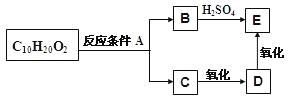
则符合上述条件的酯的结构可有
A.2种 B.4种 C.6种 D.8种
难度: 中等查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,下列说法不正确的是( )
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为2:1
C.每生成1molNa2S2O3,转移4mol电子
D.相同条件下,每吸收10m3 SO2就会释放出2.5m3CO2
难度: 中等查看答案及解析
-
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C
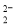 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是:
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是: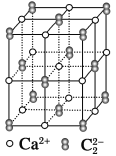
A.1个Ca2+周围距离最近且等距离的C
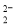 数目为6
数目为6B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
难度: 简单查看答案及解析
-
某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3。。下列推断不正确的是( )
A.AB2分子的空间构型为“V”形
B.A---B键为极性共价键,AB2分子为非极性分子
C.AB2与H2O相比,AB2的熔点、沸点比H2O的低
D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
难度: 简单查看答案及解析
-
以NA表示阿伏加德罗常数的值,下列说法错误的是
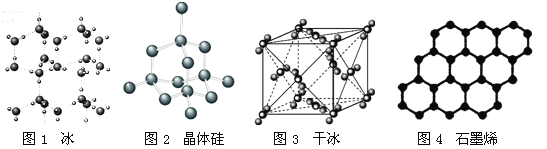
A.18g冰(图1)中含O—H键数目为2NA
B.28g晶体硅(图2)中含有Si—Si键数目为2NA
C.44g干冰(图3)中含有NA个晶胞结构单元
D.石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C—C键数目为1.5NA
难度: 中等查看答案及解析
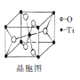
 TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。