-
化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是
A. 食物溶于水后的溶液pH <7,则该食物成为酸性食物
B. 墨水是一种胶体,不同墨水混用时可能使钢笔流水不畅或者堵塞
C. 合金材料中可能含有非金属元素
D. “火树银花”中的焰火实质上是金属元素的焰色反应
难度: 中等查看答案及解析
-
设
表示阿伏加德罗常数值。下列说法正确的是
A. 标准状况下,2.24 LNO2与N204的混合气体中含有氮原子的数目为0.1
B. 若1 L 0.2 mol/L的FeCl3溶液完全水解形成胶体,则胶体粒子数为0.2
C. 标准状况下,22.4L SO2中含有的氧原子数为3.0
D. 常温下,Na202与H20反应生成lmol02时,转移电子数是2
难度: 中等查看答案及解析
-
下列实验现象和结论相对应且正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是( )
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
B. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
C. 在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2
D. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
难度: 困难查看答案及解析
-
—种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中的有机物可用C6H10O5表示。有关说法正确的是
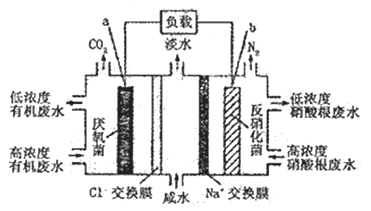
A. b电极为该电池的负极
B. b电极附近溶液的pH增大.
C. a 电极反应式:C6H1005 -22e- +6H20 =6CO2↑ +22H+
D. 中间室:Na+移向左室,Cl-移向右室
难度: 中等查看答案及解析
-
Q、W、X、Y、Z五种短周期主族元素,它们的原子序数依次增大。 已知:X和X、W和Y 分别位于同主族且W、Y质子数之和是Q、X质子数之和的2倍。下列说法不正确的是
A. Q、W、Y不可能形成离子化合物
B. 在同周期元素形成的简单气态氢化物中,Z的氢化物沸点最高
C. 原子半径的大小顺序:X>Y>W
D. X的最高价氧化物对应水化物具有酸性
难度: 中等查看答案及解析
-
在2 L恒容绝热(不与外界交换能量)容器中进行2A(g) +B(g) =2C(g)+D(s)反应,按下表数据投料,反应10 s后达到平衡状态,测得体系压强升高,前10s内v(A)= 0.025 mol/(L•s)。下列说法正确的是

A. 达平衡时,2v正(A)=v逆(B) B. 平衡后,增加D的量,平衡逆向移动
C. 到达平衡时,n(B) =0.5 mol D. 温度升高,该反应的平衡常数减小
难度: 中等查看答案及解析
-
根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
难度: 困难查看答案及解析
-
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
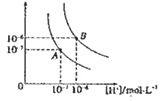
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll mol•L-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol • L-1,则溶液中 c(Na+): c(OH-)为104:1
难度: 中等查看答案及解析
-
常温下,下列有关电解质溶液的说法正确的是
A. KP/c(OH-) =1 ×l0-12 mol • L-1的溶液中Na+、Ca2+、NH4+、CH3COO、C1-可以大量共存
B. 用少量水稀释0.1 mol • L-1氨水时,溶液中c(OH-)•c(NH4+)/c(NH3•H20)减小
C. 已知AgCl的Ksp = 1.8 × 10-10,则在r任何含AgCl固体的溶液中,c(Ag+)=c(Cl-), 且Ag+与Cl-浓度的乘积等于l.8×l0-10 mol • L-1
D. 向NH4C1溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3 • H20)
难度: 困难查看答案及解析
-
下列说法不正确的是
A. 处于最低能童的原子叫做基态原子
B. 对于组成和结构相似的分子,其范德华力随若相对分子质量的增大而增大
C. 化学键可以是原子间作用力,也可以是离子间作用力
D. 3p2表示3p能级有两个轨道
难度: 中等查看答案及解析
-
下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对不发生偏移的是
A. CO2 B. N2 C. BCl3 D. PCl3
难度: 中等查看答案及解析
-
下列微粒:①CH4②NH3③CH3C00 -④NH4+⑤H20 中含有配位键的是
A. ①② B. ①③ C. ④⑤ D. ②④
难度: 中等查看答案及解析
-
下列描述中正确的是
A. CO32-的空间构型为平面三角形
B. CH4和SO3的中心原子均为sp2杂化
C. CS2为V形的极性分子
D. lmolP4中有4NA成键电子对
难度: 中等查看答案及解析
-
下列化合物的分子中,所有原子都处于同一平面的有
A. 甲苯 B. 环己烷 C. 丙烯 D. I—氯苯
难度: 中等查看答案及解析
-
下列各组中的物质均能发生消去反应的是
A. 乙烯和乙酸 B. 乙醇和乙烷 C. 苯和氣乙烯 D. 丙烯和丙烧
难度: 简单查看答案及解析
-
丁酸(C4H802)与丁醉(C4H10O)在一定条件下反应,生成的酯有
A. 4 种 B. 6 种 C. 8种 D. 10种
难度: 中等查看答案及解析
-
下列说法中不正确的是
A. 2-甲基丁烷也称异丁烷
B.
的一溴代物和
 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)C. 食用油反复加热会产生稠环芳香烃等有害物质
D. 蛋白质水解的最终产物是氨基酸
难度: 中等查看答案及解析



 (主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
(主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。