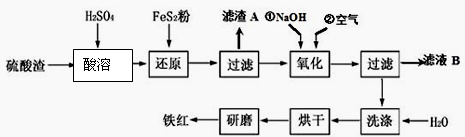
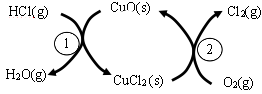
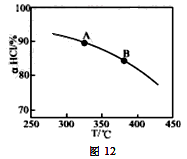
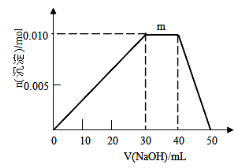
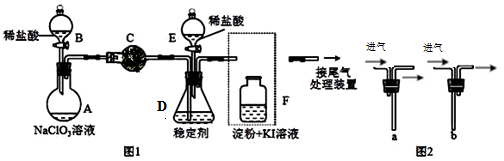
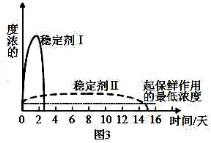
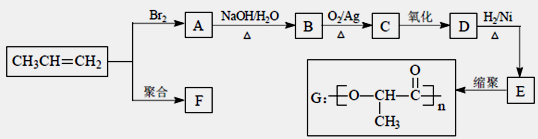
-
下列有关操作或说法正确的是
A.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
B.金属汞一旦洒落到实验室地面或桌面时,必须尽可能收集,并深埋处理
C.金属钠着火时用泡沫灭火器灭火
D.加工后具有吸水性的植物纤维可用作食品干燥剂
难度: 简单查看答案及解析
-
下列有关阿伏伽德罗常数NA说法错误的是
A.22 g 2H218O中含有的质子数为10NA
B.电解58.5 g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠
C.1.00 mol NaCl中,所有Na+的最外层电子总数为10NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
难度: 困难查看答案及解析
-
下列实验操作能达到目的的是
A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B.制取二氧化氮时,用水或NaOH溶液吸收尾气
C.为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,该方案可行。
D.为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出,
洗涤,烘干,称重。若烘干时间过长,会导致测定结果偏小。
难度: 困难查看答案及解析
-
下列物质中均含有酸性杂质,除去这些杂质的方法中正确的是
A.乙醇中含乙酸杂质:加入足量氧化钙,蒸馏
B.制氯气时,依次通过饱和NaHCO3溶液和浓硫酸净化气体
C.CO2中混有H2S通过足量的浓硫酸溶液洗气,以得到纯净的CO2
D.通过灼热的镁粉除去N2中的O2
难度: 中等查看答案及解析
-
下列说法正确的是
A.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
B.
与
互为同位素
C.H3O+和NH4+具有的电子数相同
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
难度: 中等查看答案及解析
-
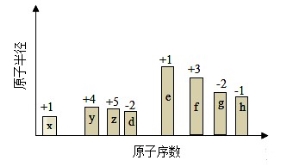
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
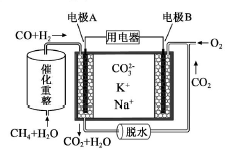
A.反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 困难查看答案及解析