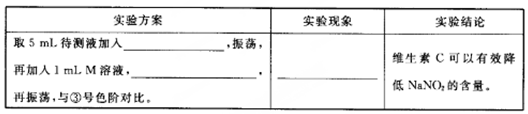
-
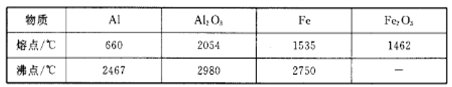
某些保健品中含有的锗元素(Ge)位于周期表的第四周期IVA族。有关锗的叙述不正确的是( )
A. 锗的原子序数为24 B. 锗的金属活动性应比硅强
C. Ge可以生成化学式为Na2GeO3的盐 D. 单质锗是半导体材料
难度: 中等查看答案及解析
-
下列关于某些离子的检验说法正确的是( )
A.向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3-
B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42-
C.向某溶液中加入浓氧氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+
D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有Cl-
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.Na2O2可作漂白剂和供氧剂,碳酸钠可用于治疗胃酸过多
B.工业上用次氯酸制漂白粉,保存漂白粉的塑料袋要密封
C.氯气用于自来水消毒,是因为生成的次氯酸有杀菌、消毒的作用
D.溴化银用于人工降雨,单质碘加入食盐中用于制加碘盐
难度: 简单查看答案及解析
-
下列关于铝及其化合物的说法中不正确的是( )
A.铝既可用于食品包装,也可用于建筑材料
B.氧化铝既可以用来冶炼铝,也可用作耐火材料
C.氢氧化铝既可以用于治疗胃酸过多的药物,也可用来制备一些铝盐
D.明矾既能用来净水,也可用作消毒剂
难度: 简单查看答案及解析
-
类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类比推出的结论最终要经过实践的检验才能决定其正确与否。下列类推结论中正确的是( )
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.Cu与Cl2直接化合生成CuCl2;Cu与S直接化合也能得到CuS
D.CO2通入到硝酸钡溶液中不能生成沉淀;SO2通入到硝酸钡溶液中也不能生成沉淀
难度: 中等查看答案及解析
-
已知Cu(NO3)2受热分解的化学反应方程式为2Cu(NO3)2=2CuO+4NO2↑+O2↑,某人将少量的Cu(NO3)2固休放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是( )
A.NO2能支持燃烧
B.NO2不能支持燃烧
C.木条复燃是因为硝酸铜分解产生了氧气的缘故
D.木条复燃是因为硝酸铜分解产生的CuO催化作用的结果
难度: 中等查看答案及解析
-
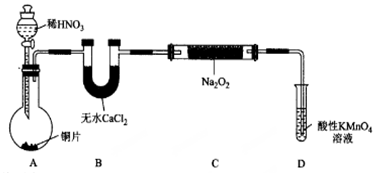
如图铁与水反应的实验中,下列做法不正确的是( )
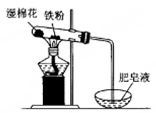
A.试管中的铁粉用绕成团的细铁丝代替
B.将试管底部的湿棉花移到试管口部
C.将铁粉附着在石棉绒上,以增大与水蒸气的接触面积
D.点燃肥皂泡验证氢气的生成
难度: 中等查看答案及解析
-
有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒情灯隔绝空气加热至恒重并排出气体后恢复到常温,测得的数据如下:
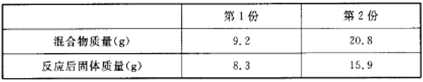
则下列叙述不正确的是( )
A.第二份得到的是纯净物
B.第l份混合物中NaOH的质量分数更大
C.根据表中数据不能计算出第1份混合物中NaHCO3的质量分数
D.第2份混合物中NaOH的物质的量小于NaHCO3的物质的量
难度: 困难查看答案及解析
-
下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
A.NaClO(aq)中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3-
B.FeC12在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
C.AlCl3(aq)中投入少量Na:Al3++4Na+2H2O=AlO2-+4Na++2H2↑
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
难度: 中等查看答案及解析
-
丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颇色变化的叙述中正确的是( )
① 新制氛水久置后→浅黄绿色消失②Cl2通入石蕊试液中→先变红后褪色③SO2通入石蕊试液中→先变红后褪色 ④SO2通入品红溶液中→红色褪去⑤ 氨气通人酚酞溶液中→红色
A.①②③④ B.②③④⑤ C.①②④⑤ D.全部
难度: 中等查看答案及解析
-
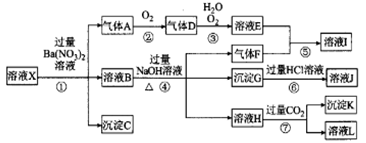
海藻中含丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程的一部分:
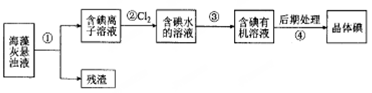
下列判断正确的是( )
A.步骤①、③的操作分别是过滤、萃取分液
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加人的有机溶剂是乙醇
D.步骡④的操作是过滤
难度: 简单查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
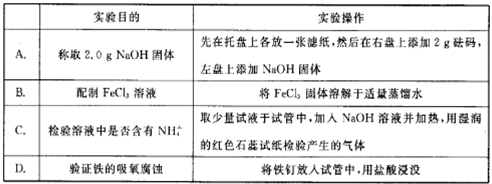
难度: 简单查看答案及解析
-
下列说法均摘自某科普杂志,你认为无科学性错误的是( )
① 铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
② 一氧化碳有毒,生有煤炉的居室,可放置数盆水,这样可有效地吸收一氧化碳,以防煤气中毒
③ “汽水”浇灌植物有一定道理,其中二氧化碳的缓释,有利于作物的光合作用
④ 硅的提纯与应用,促进了半导体元件与集成芯业的发展,可以说“硅是信息技术革命的催化剂”
A.①③ B.③④ C.①④ D.②③
难度: 中等查看答案及解析
-
将3.48g四氧化三铁完全溶解在100mL 1mol/L的硫酸中,然后加入K2Cr2O7溶液25 mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
A.0.05mol/L B.0.1 mol/L C.0.2 mol/L D.0.3 mol/L
难度: 困难查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D.1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2gFe
难度: 中等查看答案及解析
-
将15.6g Na2O2和5.4gAl同时放入一定量的水中,充分反应后得到200ml溶液,再向该溶液中缓慢通人标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A.标准状况下,反应过程中得到7.84L的气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8g的沉淀
D.最终得到的溶液中c(Na+)=1.5mol/L
难度: 困难查看答案及解析
-
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品红溶液、石蕊试液、淀粉-KI试液、Na2S溶液、KBr溶液、含KSCN的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
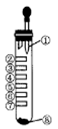
A.产生氯气的离子方程式:16H++ 10Cl-+2MnO4-=2Mn2++5Cl2↑+8H2O
B.⑦处变血红色,是因为2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3
C.②褪色,③处先变红后褪色,⑤处出现淡黄色固体
D.④处变蓝,⑥处变橙红,能说明氧化性:Cl2>Br2>I2
难度: 中等查看答案及解析
-
将Cl2通入适量KOH溶液,产物中可能有KCl、kClO、KClO3,且
的值与温度高低有关,当n(KOH)=amol时,下列有关说法错误的是( )
A.若某温度下,反应后
=11,则溶液中
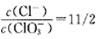
B.参加反应的氯气的物质的量等于
C.改变温度,产物中转移电子的物质的量n的范围:
D.改变温度,产物中KClO3的最大理论产量为
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中.溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中,①②两种操作生成的CO2体积之比为3:2
D.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b
难度: 简单查看答案及解析
-
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),打开K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
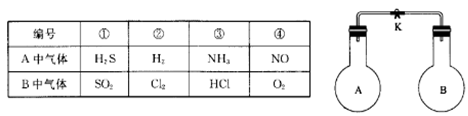
A.②③④① B.③①④② C.③②①④ D.④③②①
难度: 中等查看答案及解析
-
有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A.肯定有Al3+、Mg2+、NH4+、Cl- B.肯定有Al3+、Mg2+、HCO3-
C.肯定有K+、HCO3-、MnO4- D.肯定有Al3+、Mg2+、SO42-
难度: 简单查看答案及解析
-
为了实验探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及实验现象如图所示,结合实验现象判断,该同学得出的下列结论中正确的是( )

A.向滤液中滴加盐酸的实验现象是产生白色沉淀
B.滤渣可能是两种金属单质的混合物
C.滤渣在足量的稀硝酸中能完全溶解
D.加入的金属M可能是镁或钠
难度: 困难查看答案及解析
-
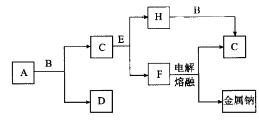
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
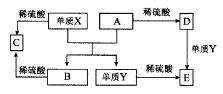
则下列说法正确的是( )
A.单质X与A反应的化学方程式:Al2O3+2Fe
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓
C.单质X和单质Y在一定条件下均能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性化合物
难度: 中等查看答案及解析
-
现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
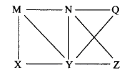
A.N一定是HCl(aq) B.X可能为Al或Cl2
C.Y一定为NaOH(aq) D.Q、Z中的一种必定为Al2O3
难度: 中等查看答案及解析
-
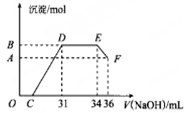
已知:2NaAlO2+CO2+3H2O→2Al(OH)3↓+Na2CO3,向含2 mol NaOH、1 molBa(OH)2、2mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是( )

难度: 困难查看答案及解析
-
向21.6gFe粉和Cu粉的混合物中加入1L1mol/L HNO3充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO3-)为(忽略溶液体积的变化)( )
A.0.45mol/L B.0.6 mol/L C.0.75 mol/L D.0.9 mol/L
难度: 中等查看答案及解析
-
若用X代表F、C1、Br、I四种卤族元素,下列能够表达它们的共性反应的是( )
A. X2+H2=2HX B. X2+H2O=HX+HXO
C. 2Fe+3X2=2FeX3 D. X2+2NaOH=NaX+NaXO+H2O
难度: 中等查看答案及解析
-
下列物质的保存方法正确的是( )
A. 用橡皮寒把液溴密封于玻璃瓶中
B. 用磨口玻璃塞把氢氟酸密封于棕色试剂瓶中
C. 把氯气加压液化后密封于钢瓶中
D. 氯水通常保存于无色试剂瓶中
难度: 简单查看答案及解析
-
在下列变化① 大气固氮、② 硝酸银分解、③ 实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是( )
A.①②③ B.②①③ C.③②① D.③①②
难度: 简单查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
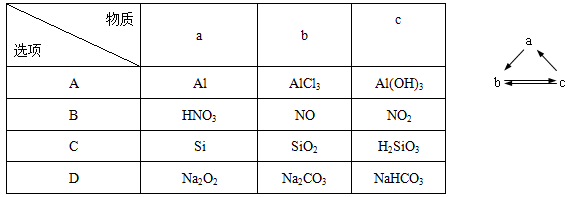
难度: 中等查看答案及解析