-
化学与社会、生活息息相关。下列说法不正确的是
A.煤的液化、海带中提碘、焰色反应等都涉及化学变化
B.利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
C.国产大飞机一C919使用的碳纤维是一种新型的无机非金属材料
D.浮梁巧烧瓷,颜色比琼玖”,描述的是我国驰名于世的陶瓷,陶瓷是一种硅酸盐产品
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.中子数为8 的氧原子:
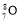 B.HCl 的电子式:
B.HCl 的电子式: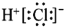
C.NH3的结构式:
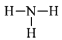 D.Cl−的结构示意图:
D.Cl−的结构示意图: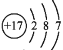
难度: 简单查看答案及解析
-
下列有关物质分类的说法正确的是( )
A. HNO3是一元酸、强酸、挥发性酸是按性质进行分类的
B. FeO、Fe2O3、Fe3O4都是碱性氧化物
C. 漂白液、液化石油气、铝热剂都是混合物
D. 无水乙醇、一水合氨、熔融MgSO4都是电解质
难度: 中等查看答案及解析
-
朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是( )
A.发生丁达尔效应 B.雾是一种胶体,胶粒带相同电荷
C.空气中的小水滴颗粒直径大小约为1~100 nm D.空气中的小水滴颗粒在运动
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为
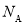 。下列说法正确的是
。下列说法正确的是A.1L0.1mol·
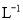 NH4Cl溶液中,
NH4Cl溶液中,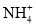 的数量为0.1
的数量为0.1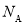
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1
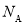
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2
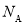
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2
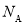
难度: 困难查看答案及解析
-
取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
A.0.21 mol·L-1 B.0.42 mol·L-1
C.0.56 mol·L-1 D.0.26 mol·L-1
难度: 简单查看答案及解析
-
在无土栽培中,需配制1 L 含0.50 mol·L-1 NH4Cl、0.16 mol·L-1 KCl、0.24 mol·L-1 K2SO4的混合溶液,但当时没有K2SO4固体,若用(NH4)2SO4固体代替,需用KCl、NH4Cl、(NH4)2SO4三种固体的物质的量分别为
A.0.40、0.50、0.12 B.0.66、0.50、0.24
C.0.64、0.50、0.24 D.0.64、0.02、0.24
难度: 简单查看答案及解析
-
某位同学配制一定物质的量浓度的NaOH溶液,造成所配溶液浓度偏高的原因是
A.所用NaOH已经潮解
B.定容时俯视刻度线
C.有少量NaOH残留在烧杯中
D.用带游码的托盘天平称2.4 g NaOH时误用了“左码右物”方法
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A. NaHCO3=Na++H++ CO32- B. H2SO3
 2H++SO32-
2H++SO32-C. Ba(OH)2=Ba2+ + 2OH- D. AgCl
 Ag++Cl-
Ag++Cl-难度: 简单查看答案及解析
-
在室温下,下列离子组在指定溶液中一定能大量共存的是
A.使石蕊变蓝的溶液:K+、Na+、
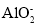 、OH-
、OH-B.加入铝粉产生气体的溶液:Cu2+、Mg2+、
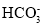 、Cl-
、Cl-C.使甲基橙变红的溶液:K+、Fe2+、
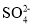 、
、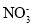
D.含有1 mol·L-1 Al3+的溶液:H+、Fe3+、
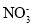 、
、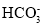
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3-
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl﹣
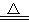 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2OD.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
难度: 简单查看答案及解析
-
有7瓶氯盐溶液,阳离子分别是Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH4+、Na+等离子的溶液,只用一种试剂即可鉴别,该试剂可能是
A.KMnO4溶液 B.KSCN溶液 C.NaOH溶液 D.NH3·H2O溶液
难度: 中等查看答案及解析
-
下列转化过程中必须加还原剂才能实现的是 ( )
A.
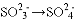 B.
B. 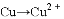 C.
C. 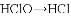 D.
D. 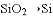
难度: 中等查看答案及解析
-
某种飞船以N2H4和N2O4为动力源,反应方程式为2N2H4+N2O4===3N2+4H2O,反应温度高达2700 ℃,对于该反应,下列说法正确的是
A.N2H4是氧化剂 B.N2O4是还原剂
C.N2既是氧化产物又是还原产物 D.每生成3molN2转移电子的数目为16NA
难度: 简单查看答案及解析
-
[2016全国Ⅰ]下列实验操作能达到实验目的的是
A.用长颈漏斗分离出乙酸与乙醇反应的产物
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
难度: 中等查看答案及解析
-
下述实验设计能够达到目的的是
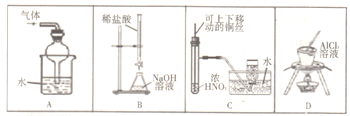
A.吸收易溶于水的气体 B.测定NaOH溶液浓度
C.制备并收集少量NO2 D.制取无水AlCl3
难度: 中等查看答案及解析
-
V mL Fe2(SO4)3溶液中含a g SO42-,取出溶液0.5V mL,用水稀释成2V mL,则稀释后溶液中Fe3+的物质的量浓度是
A.
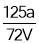 mol·L-1 B.
mol·L-1 B.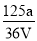 mol·L-1
mol·L-1C.
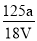 mol·L-1 D.
mol·L-1 D.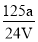 mol·L-1
mol·L-1难度: 中等查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是
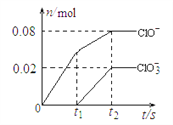
A.苛性钾溶液中KOH的质量是5.6 g
B.反应中转移电子的物质的量是0.18mol
C.在酸性条件下 ClO- 和ClO3-可生成Cl2
D.一定有3.136 L氯气参与反应
难度: 困难查看答案及解析
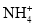 、K+、Ba2+、Al3+、Fe3+、I-、
、K+、Ba2+、Al3+、Fe3+、I-、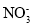 、
、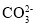 、
、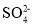 、
、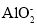 。取该溶液进行以下实验:
。取该溶液进行以下实验: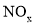 以及燃煤废气中的
以及燃煤废气中的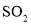 都是大气污染物,对它们的治理具有重要意义。
都是大气污染物,对它们的治理具有重要意义。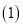 氧化还原法消除
氧化还原法消除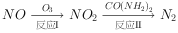
 反应Ⅰ为
反应Ⅰ为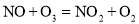 ,生成标准状况下
,生成标准状况下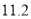 L
L 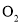 时,转移电子的物质的量是______
时,转移电子的物质的量是______ 反应Ⅱ中,当
反应Ⅱ中,当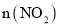 :
: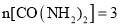 :2时,氧化产物与还原产物的质量比为______。
:2时,氧化产物与还原产物的质量比为______。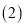 使用“催化转化器”可以减少尾气中的CO和
使用“催化转化器”可以减少尾气中的CO和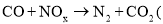 未配平
未配平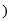 ,若
,若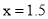 ,则方程式中
,则方程式中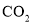 和
和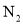 的化学计量数之比为______。
的化学计量数之比为______。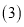 吸收
吸收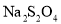 和
和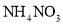 产品的流程图如图所示
产品的流程图如图所示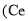 为铈元素
为铈元素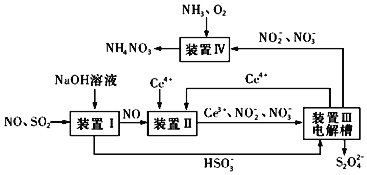
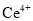 氧化的产物主要是
氧化的产物主要是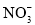 和
和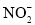 ,请写出生成等物质的量的
,请写出生成等物质的量的 已知进入装置Ⅳ的溶液中
已知进入装置Ⅳ的溶液中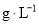 ,要使1
,要使1  该溶液中的
该溶液中的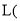 用含a代数式表示,结果保留整数
用含a代数式表示,结果保留整数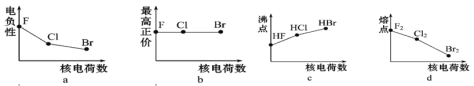
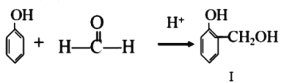
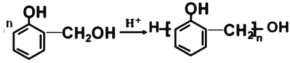 +(n-1)H2O
+(n-1)H2O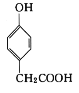 也能与CH3CHO发生类似反应①的反应,生成有机化合物Ⅲ,该反应化学方程式为____;写出化合物Ⅱ与足量NaHCO3反应的化学方程式____。
也能与CH3CHO发生类似反应①的反应,生成有机化合物Ⅲ,该反应化学方程式为____;写出化合物Ⅱ与足量NaHCO3反应的化学方程式____。