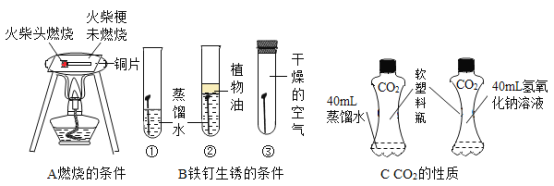
-
小明的爷爷种了一亩的小白菜,他发现白菜叶片发黄,为缓解这一现象,购买了尿素[CO(NH2)2)]进行施肥,尿素是( )
A.氮肥 B.磷肥 C.钾肥 D.钙肥
难度: 简单查看答案及解析
-
规范操作是科学实验的基本要求,下列实验操作符合规范要求的是( )
A.
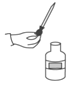 取用液体 B.
取用液体 B.  量取液体
量取液体C.
 倾倒液体 D.
倾倒液体 D.  加热液体
加热液体难度: 简单查看答案及解析
-
以下四个化学反应中,其所属基本反应类型正确的是( )
选项
化学反应方程式
反应类型
A
Fe+S
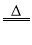 FeS
FeS分解反应
B
CO+CuO
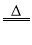 Cu+CO2
Cu+CO2置换反应
C
2KClO3
 2KCl+3O2↑
2KCl+3O2↑化合反应
D
Na2CO3+2HCl═2NaCl+H2O+CO2↑
复分解反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
抗击新冠肺炎疫情中,一种名为瑞德西韦(分子式:C27H35N6O8P)的新药被寄予厚望,认为该新药或许会成为抗击新冠肺炎的“特效药”。下列说法正确的是( )
A.瑞德西韦是一种混合物
B.瑞德西韦分子的相对分子质量是77
C.瑞德西韦分子中的氢原子和磷原子的质量比为35:31
D.瑞德西韦由27个碳原子、35个氢原子、6个氮原子、8个氧原子和1个磷原子构成
难度: 简单查看答案及解析
-
归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )
A.有机物是一类含碳化合物,所以CH4、CO2都是有机物
B.金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气
C.硫酸、盐酸电离时都能产生H+,所以电离时只要能产生H的化合物都是酸
D.氧化物是由两种元素组成,其中一种是氧元素的化合物,所以水是氧化物
难度: 中等查看答案及解析