-
短周期主族元素X、Y、Z、W的原子序数依次增大。X与W同主族,X、W的单质在标准状况下的状态不同。Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。下列说法正确的是( )
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.化合物X2Z2与W2Z2所含化学键类型完全相同
难度: 中等查看答案及解析
-
分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列说法中正确的是
A.单质硅是将太阳能转变为电能的常用材料
B.医用酒精的浓度通常为95%
C.合成纤维和光导纤维都是新型无机非金属材料
D.淀粉、纤维素和油脂都属于天然高分子化合物
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.一定条件下,将2molSO2与足量氧气反应,生成SO3的分子数为2NA
B.标准状况下,11.2L乙醇中含有羟基的数目为0.5NA
C.4.6g由NO2和N2O4组成的混合气体中含有氧原子的数目为0.2NA
D.常温下CH3COONH4的pH=7,则0.5mol·L-1的CH3COONH4溶液中,NH4+浓度为0.5mol·L-1
难度: 简单查看答案及解析
-
实验室制备硝基苯时,经过配制混酸、硝化反应(50~60℃)、洗涤分离、干燥蒸馏等步骤,下列图示装置和原理能达到目的的是( )。
A.
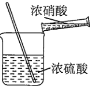 配置混酸 B.
配置混酸 B.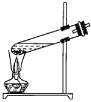 硝化反应
硝化反应C.
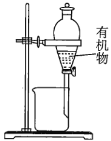 D.
D.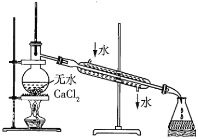 蒸馏硝基苯
蒸馏硝基苯难度: 中等查看答案及解析
-
技术人员用一种三室微生物燃料电池处理污水,原理如图所示,图中有机废水中的有机物可以用C6H10O5表示。下列说法不正确的是
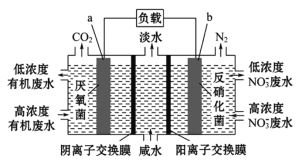
A.a极是电池的负极
B.b极附近的溶液pH增大
C.a极的电极反应式为C6H10O5+24e-+7H2O
 6CO2↑+24H+
6CO2↑+24H+D.若反应中转移的电子数为20NA,则生成N2在标准状况下的体积为44.8L
难度: 中等查看答案及解析
-
常温下,向 0.1mol/LNa2A溶液中不断通入HCl。H2A、HA-、A2-在溶液中所占物质的量分数与 pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )
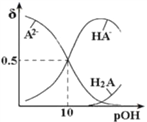
A.H2A的第二级电离平衡常数为10-10
B.随着HCl的通入 c(H+)/c(H2A)先减小后增大
C.当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-)
D.将等浓度等体积的 Na2A与H2A溶液混合后,溶液显碱性
难度: 中等查看答案及解析
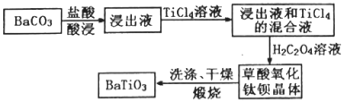
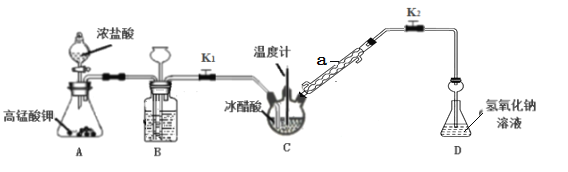
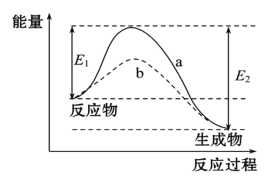
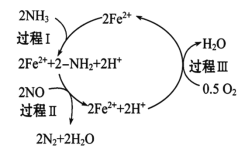
 CO2(g)+H2(g),得到如表所示的三组数据:
CO2(g)+H2(g),得到如表所示的三组数据: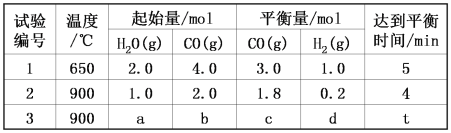
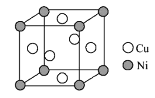
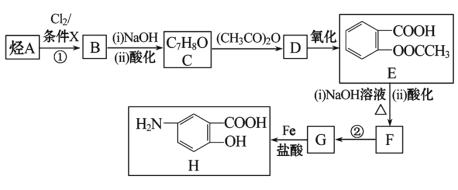
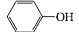
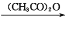
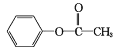
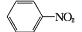

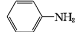 (易被氧化)
(易被氧化)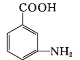 的合成路线______________________________________。
的合成路线______________________________________。