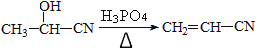
-
化学与生活息息相关。下列说法正确的是
A. 光导纤维的主要成分是高纯硅
B. 汽油、煤油、植物油的主要成分都是烃
C. 在糕点包装袋内放置活性铁粉作抗氧化剂
D. 轮船船身连接锌块叫做外接电源的阴极保护法
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O===HClO+HSO3-
B. 0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加。W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W的简单氢化物常温下呈液态,Y的氧化物和氯化物熔融时都能导电,X、Y和Z原子的最外层电子数之和为10。下列说法正确的是
A. 离子半径: W<Y<Z
B. 工业上采用电解Y 的氧化物冶炼单质Y
C. W、X元素组成的化合物一定只含离子键
D. W、X、Z三种元素组成的化合物的水溶液可能显碱性
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 化学反应中每生成1molO2,转移的电子数为4NA
D. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
难度: 中等查看答案及解析
-
如图 a、b、c、d均为铂电极,供选择的电解质溶液如下表。要满足条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则应选用的电解液是
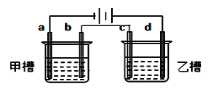
组
A
B
C
D
甲槽
KCl
NaCl
NaOH
Cu(NO3)2
乙槽
AgNO3
NaNO3
CuSO4
NaCl
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于常见有机物的说法不正确的是
A. 乙醇与乙酸都可以与钠反应
B. 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯
C. 1mol有机物
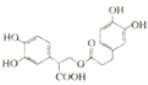 一定条件下能和6 mol NaOH反应
一定条件下能和6 mol NaOH反应D. 分子式为C4H7ClO2,可与 NaHCO3溶液反应产生CO2的有机物可能结构有6种
难度: 中等查看答案及解析
-
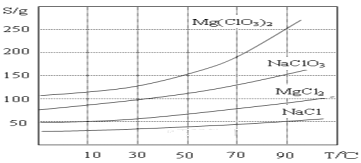
下列是从海藻灰和智利硝石矿层中提取碘的主要反应,下列说法正确的是
①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2
A. 氧化性:MnO2>SO42->IO3->I2
B. 反应①②中生成等量的I2时转移电子数之比为1∶5
C. I2在反应①中是还原产物,在反应②中是氧化产物
D. NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO3-)>c(H2SO3)>c(SO32-)
难度: 中等查看答案及解析
 CH3OH(g) +H2O(g) △H1=-57.8 kJ/mol
CH3OH(g) +H2O(g) △H1=-57.8 kJ/mol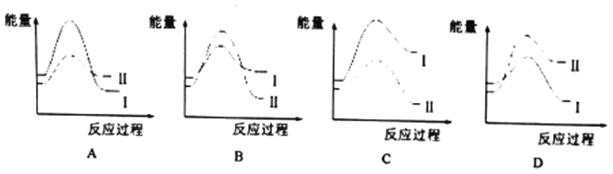
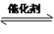 4N2(g) +6H2O(g) △H <0
4N2(g) +6H2O(g) △H <0
 表示V,
表示V, 表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。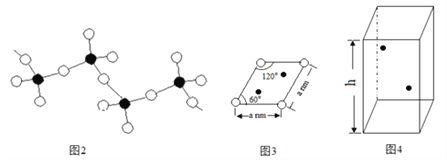
 标出V原子的位置____________;
标出V原子的位置____________;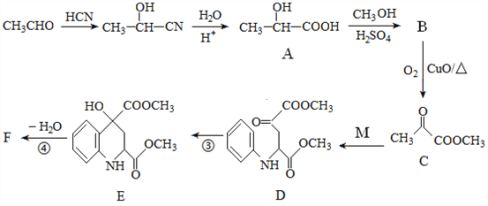
 。
。