-
下列说法中,不正确的是
A.反应热指的是反应过程中放出的热量
B.原电池的负极发生氧化反应
C.伴随能量变化的不一定是化学变化
D.电解池的阳极发生氧化反应
难度: 中等查看答案及解析
-
已知下列热化学方程式:H2(g)+1/2O2(g)== H2O(l) △H= -285.8kJ/mol,
H2(g)+1/2O2(g)== H2O(g) △H= -241.8kJ/mol则氢气的标准燃烧热是
A.-285.8kJ/mol B. 285.8kJ/mol
C. -241.8kJ/mol D. 241.8kJ/mol
难度: 简单查看答案及解析
-
下列变化中,属于放热反应的是
A.H2O(g)==H2O(l) △H= -44kJ/mol
B.2HI(g)==H2(g)+I2(g) △H=+14.9kJ/mol
C.能量变化如右图所示的化学反应
D.形成化学键时放出能量的化学反应
难度: 中等查看答案及解析
-
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示。下列叙述中正确的是

A.黑磷比白磷稳定
B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
难度: 中等查看答案及解析
-
理论上不能用于设计成原电池的反应是
A. 2H2(g)+O2(g)==2H2O(l) △H<0
B.HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) △H<0
C.2Al(s)+3Cl2(g)==2AlCl3(s) △H<0
D.Zn(s)+2HCl(aq)==ZnCl2+H2(g) △H<0
难度: 简单查看答案及解析
-
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
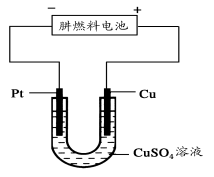
用铂电极电解某溶液一段时间,该溶液浓度增大而pH减小,该溶液是
A.NaOH B.CuCl2 C.CuSO4 D.H2SO4
难度: 简单查看答案及解析
-
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作
A.阴极 B.阳极 C.正极 D.负极
难度: 简单查看答案及解析
-
下列说法正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程
B.合金都比纯金属易被腐蚀
C.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀
D.钢铁设备上连接铜块可以防止钢铁被腐蚀
难度: 简单查看答案及解析
-
已知在1×lO5 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+ 1/2O2 (g)△H=+242 kJ.mol-1
B.2H2(g)+O2(g)=2H2O(l) △H= -484 kJ.mol-l
C.H2(g)+ 1/2O2(g)=H2O(g) △H=+242 kJ.mol-l
D.2H2(g) + O2(g) = 2 H2O(g) △H= -484 kJ
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2 (g) △H= -566 kJ.mol-1
Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g) △H= -226 kJ.mol-1
根据以上热化学方程式判断,下列说法正确的是
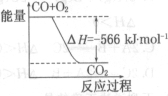
A.CO的燃烧热为283 kJ
B.图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H= - 452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2x6.02×l023
难度: 中等查看答案及解析
-
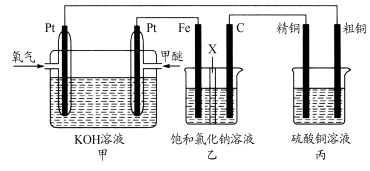
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH-
3H2↑+FeO
。下列说法正确的是
A.铁为阳极,H2SO4为电解液
B.铁为阴极,浓NaOH为电解液
C.阳极发生的电极反应为Fe+8OH--6e-===4H2O+FeO
D.铁失去3 mol电子可以在阴极得到33.6 L氢气
难度: 中等查看答案及解析
-
反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是


难度: 简单查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 中等查看答案及解析
-
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是
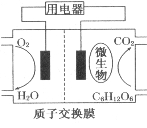
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况 下CO2气体22.4/6 L
难度: 中等查看答案及解析
-
通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下列是一些化学键的键能。
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol-1)
414
489
565
155
根据键能数据估算反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为
A.-1 940 kJ·mol-1 B.1 940 kJ·mol-1 C.-485 kJ·mol-1 D.485 kJ·mol-1
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)
2HI(g) ΔH=-9.48 kJ/mol
(ii) I2(S)+ H2(g)
2HI(g) ΔH=+26.48 kJ/mol.
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 中等查看答案及解析
-
已知外电路中,电子由铜流向a极。有关如上图所示的装置分析合理的一项是

A.该装置中Cu极为正极
B.一段时间后锌片质量减少
C.b极的电极反应式:H2-2e-
2H+
D.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
难度: 中等查看答案及解析
-
有下列4种燃料电池的工作原理示意图,其中正极反应的产物为水的是

难度: 中等查看答案及解析
-
以铁(足够)为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后溶液中只有一种沉淀为2 mol Fe(OH)3,则消耗水的物质的量共为
A.2 mol B.3 mol C.4 mol D.5 mol
难度: 中等查看答案及解析
-
美国一个海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800 ℃。已知该电池的总反应为2H2+O2
2H2O,负极反应为H2+
-2e-
H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e-
O2↑+2H2O
B.放电时,
向负极移动
C.电池供应1 mol水蒸气,转移的电子的物质的量为4 mol
D.放电时
向正极移动
难度: 困难查看答案及解析
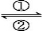 Ag2O+Zn+H2O,回答下列有关问题。
Ag2O+Zn+H2O,回答下列有关问题。