-
下列措施不合理的是
A.用SO2漂白纸浆和草帽辫 B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅 D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
难度: 中等查看答案及解析
-
下列各组有机物中,一定不属于同一类物质的是
A.CH4与C3H8 B.C2H2与C3H4
C.CH3CH2COOH与CH3COOCH3 D.CH3COOH与HCOOH
难度: 简单查看答案及解析
-
下列说法正确的是
A.乙烯和苯都能使酸性KMnO4溶液褪色
B.甲烷和乙醇均能发生取代反应
C.在任何条件下,苯和乙烯均不能发生加成反应
D.苯酚和甲苯遇FeCl3均显紫色
难度: 简单查看答案及解析
-
下表中,对有关除杂的方法错误的是
选项
物质
杂质
方法
A
苯
苯酚
加浓溴水后过滤
B
乙烯
CO2和SO2
通入装有NaOH溶液的洗气瓶洗气
C
溴苯
Br2
加NaOH溶液后分液
D
乙酸乙酯
乙酸
加饱和碳酸钠溶液后分液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2020年新型冠病毒疫情在全世界爆发,化合物
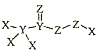 可用于新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是
可用于新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是A.原子半径:X>Y>Z B.该化合物中Z的化合价均呈-2价
C.元素的非金属性:X>Z D.Z的简单阴离子比Na的简单阳离子半径大
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
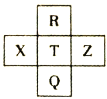
A.非金属性:Z<T<X
B.R与Q的电子数相差16
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
难度: 简单查看答案及解析
-
下列实验的现象与对应结论均正确的是
选项
操作
现象
结论
A
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有吸水性和强氧化性
B
常温下将Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
C
将一小块Na放入无水乙醇中
产生气泡
Na能置换出醇羟基中的氢
D
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
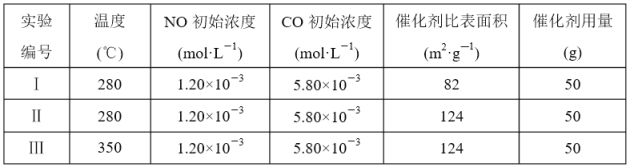
NO和CO都是汽车尾气中有害物质,它们能缓慢地起反应:2NO(g)+2CO(g)
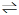 2CO2(g)+N2(g)△H=-746.8kJ/mol,利用该反应来净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g)△H=-746.8kJ/mol,利用该反应来净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是A.增大压强同时加催化剂 B.降低温度
C.升高温度 D.及时将CO2和N2从反应体系中移走
难度: 简单查看答案及解析
-
在水溶液中能大量共存的一组离子是
A.Fe2+、Al3+、ClO-、Cl- B.K+、Cu2+、OH-、
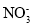
C.
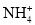 、Na+、Br-、
、Na+、Br-、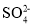 D.Mg2+、H+、
D.Mg2+、H+、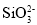 、
、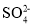
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,23gNO2和N2O4的混合气体中含有NA个氧原子
B.1L0.1mol/L的氨水含有0.1NA个OH—
C.1molFe与足量稀HNO3反应,转移2NA个电子
D.一定条件下,1molNa与O2反应,生成的产物中含有Na2O和Na2O2,发应过程中转移了2NA个电子
难度: 简单查看答案及解析
-
下列陈述正确并且有因果关系的是
选项
陈述I
陈述II
A
SO2有漂白性
SO2可使溴水褪色
B
SiO2有导电性
SiO2可用于制备光导纤维
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和H2S
D
Fe3+有强氧化性
FeCl3溶液可用于回收废旧电路板中的铜
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列文字表述与反应方程式对应正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2COO-+H2O
C.实验室用液溴和苯在催化剂作用下制溴苯:
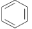 +Br2
+Br2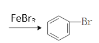 +HBr
+HBrD.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+
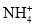
难度: 中等查看答案及解析
-
25℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol/L
B.饱和小苏打溶液中:c(Na+)=c(
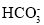 )
)C.pH为2的盐酸与等体积pH=12的氨水混合后所得溶液显酸性
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol/L
难度: 中等查看答案及解析
-
对于0.1mol/L的Na2SO3溶液,正确的是
A.加入少量NaOH固体,c(
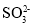 )与c(Na+)均增大
)与c(Na+)均增大B.c(Na+)=2c(
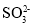 )+c(
)+c(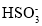 )+c(H2SO3)
)+c(H2SO3)C.c(Na+)+c(H+)=2c(
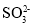 )+2c(
)+2c(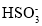 )+c(OH-)
)+c(OH-)D.升高温度,溶液的pH降低
难度: 困难查看答案及解析
-
下列实验不能达到目的的是
A.用饱和NaHCO3溶液除去CO2中混有的HCl
B.用加热蒸干CuCl2溶液的方法制备无水CuCl2固体
C.用分液漏斗分离CCl4萃取碘水后已分层的有机层和水层
D.用酸性KMnO4溶液验证草酸的还原性
难度: 简单查看答案及解析
-
下列说法不正确的是
A.漂白粉长时间露置在空气中会结块变质
B.把NaHSO4溶液加入NaAlO2溶液中生成白色沉淀,然后沉淀又溶解
C.蘸有浓硫酸的玻璃棒接近浓氨水瓶口有白烟产生
D.装强碱溶液的试剂瓶需要用橡胶塞,长时间后会在瓶口有白色固体生成
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
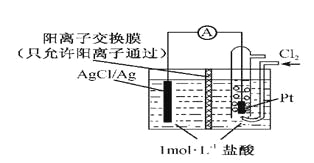
A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析
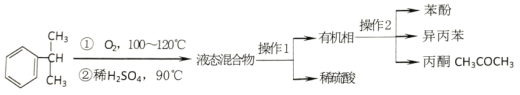
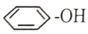 +28KMnO4+42H2SO4
+28KMnO4+42H2SO4 28MnSO4+14K2SO4+30CO2↑+57H2O
28MnSO4+14K2SO4+30CO2↑+57H2O
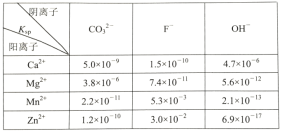
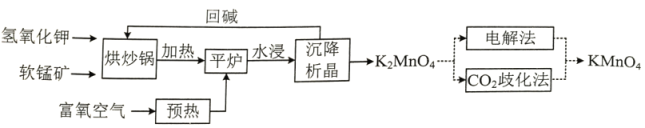
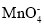 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O). 2CO2(g)+N2(g)H=-746.8kJ/mol
2CO2(g)+N2(g)H=-746.8kJ/mol