-
对于化学反应能否自发进行,下列说法中错误的是( )
A.若ΔH<,ΔS>0,任何温度下都能自发进行
B.若ΔH>0,ΔS<0,任何温度下都不能自发进行
C.若ΔH>0,ΔS>0,低温时可自发进行
D.若ΔH<0,ΔS<0,低温时可自发进行
难度: 中等查看答案及解析
-
在下列过程中,需要加快化学反应速率的是( )
A.炼钢 B.食物腐败 C.钢铁腐蚀 D.塑料老化
难度: 简单查看答案及解析
-
下列变化,属于吸热过程的是( )
A.浓H2SO4溶于水 B.甲烷燃烧
C.CaO与水反应 D.Ba(OH)2晶体与NH4Cl反应
难度: 中等查看答案及解析
-
下列变化中,一定不存在化学能与热能相互转化的是( )
①燃放爆竹 ②碘的升华 ③金属钝化 ④铝热反应 ⑤干冰汽化 ⑥加热氯化铵 ⑦浓硫酸稀释
A.①③④⑤ B.②④⑤⑦ C.②⑤ D.以上选项都不正确
难度: 简单查看答案及解析
-
考察下述自然界的一些自发变化,可发现它们有一些共同的特点。下列说法不正确的是

A.都有一定的方向性,按某一物理量标度由高到低自发进行
B.都可以用来做功,自发过程一旦发生后体系做功的本领就会降低
C.有一定的进行限度,自发过程总是单向地趋向于非平衡状态
D.有一定的数据差来判断自发变化能否发生
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
 CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A.增加H2O的量
B.将容器的体积缩小一半
C.使体积不变,充氮气使体系压强增大
D.使压强不变,充氮气使容器体积增大
难度: 简单查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c上产生大量气泡,b、d相连时,b上产生大量气泡,则四种金属的活动性顺序由强到弱的是
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
下面有关电化学的图示,完全正确的是
A.

B.

C.
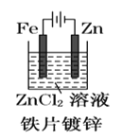
D.

难度: 中等查看答案及解析
-
在10L容器中进行如下反应:A(g)+B(g)
 2C(g),2分钟后,B由2mol减少到1.2mol,则用单位内A的浓度变化表示的反应速率(VA)是 ( )
2C(g),2分钟后,B由2mol减少到1.2mol,则用单位内A的浓度变化表示的反应速率(VA)是 ( )A.0.02mol/(L·min) B.0.04mol/(L·min)
C.0.08mol/(L·min) D.0.8mol/(L·min)
难度: 中等查看答案及解析
-
可逆反应A+3B
 2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )A.② B.④ C.①和④ D.②和③
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
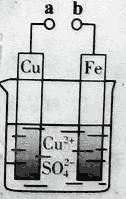
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 中等查看答案及解析
-
在一密闭容器中,等物质的量的X和Y发生如下反应:X(g)+2Y(g)
 2Z(g),反应达到平衡时,混合气体中X和Y的物质的量之和与Z的物质的量相等,则X的转化率为( )
2Z(g),反应达到平衡时,混合气体中X和Y的物质的量之和与Z的物质的量相等,则X的转化率为( )A.40%
B.50%
C.60%
D.70%
难度: 简单查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.
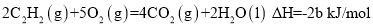
B.

C.
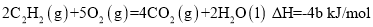
D.
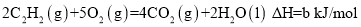
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2mol•L-1 降到 0.8mol•L-1 需要 20s,那么反应物浓度再由 0.8mol•L-1 降到 0.2mol•L-1 所需要的时间为
A.10s B.大于 10s C.小于 10s D.无法判断
难度: 中等查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O
 Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
难度: 简单查看答案及解析
-
下列各装置中都盛有0.1 mol·L-1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是:( )


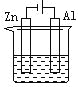

① ② ③ ④
A.③①④② B.①②④③ C.①②③④ D.②①④③
难度: 简单查看答案及解析
-
钢铁的锈蚀过程中,下列五种变化可能发生的是:①Fe由+2价转化为+3价;②O2被还原;③H+ 被还原;④有Fe2O3·H2O生成;⑤杂质碳被氧化除去
A.①② B.③④ C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1 ②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1由此可以推断下列结论正确的是( )
A.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
B.①的焓变为221 kJ·mol-1
C.浓硫酸与稀NaOH溶液完全反应生成1 mol水时放热为57.3 kJ
D.1 mol碳完全燃烧放出的热大于110.5 kJ
难度: 简单查看答案及解析
-
可逆反应:
 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )①单位时间内生成
 的同时生成
的同时生成
②单位时间内生成
 的同时生成
的同时生成
③用
 、
、 、
、 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g)
 xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是A.x的值为2 B.A的转化率为40%
C.B的平衡浓度为0.8 mol·Lˉ1 D.D的体积分数为20%
难度: 中等查看答案及解析
 PCl3(g)+Cl2(g) ____;
PCl3(g)+Cl2(g) ____;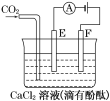

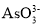 +2OH-=2I-+
+2OH-=2I-+ +H2O,此时D为____极,发生________反应。
+H2O,此时D为____极,发生________反应。