-
下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的金属性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
难度: 中等查看答案及解析
-
据报道,氢燃料电池公交汽车已经驶上北京街头,下列说法中,正确的是
A. 电解水制取氢气是理想而经济的制氢方法
B. 发展氢燃料电池汽车不需要安全高效的储氢技术
C. 氢燃料电池汽车的使用可以有效减少城市空气污染
D. 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
难度: 中等查看答案及解析
-
根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )
A.固体氯化钠溶于水 B.氯化铵受热分解生成氯化氢和氨气
C.冰经加热变成水蒸气 D.氯化氢溶于水
难度: 中等查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。下列有关我们常用的元素周期表的说法正确的是( )
A.元素周期表有七个横行,也是七个周期
B.元素周期表有18个纵行,即有18个族
C.短周期是指第一、二、三、四周期
D.ⅠA族的元素全部是金属元素
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2的反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
已知空气—锌电池的电极反应为锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:O2+2H2O+4e-=4OH-,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
难度: 简单查看答案及解析
-
对于放热反应H2+Cl2
 2HCl,下列说法中,正确的是
2HCl,下列说法中,正确的是A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量
D.该反应中,化学能只转变为热能
难度: 简单查看答案及解析
-
下列化合物中,既有离子键,又有共价键的是
A.KOH B.CaCl2 C.H2O D.NH3
难度: 中等查看答案及解析
-
下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,稀硫酸 B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸 D.铜片、银片,FeCl3溶液
难度: 简单查看答案及解析
-
下列有关化学用语表达不正确的是( )
A.氮气的电子式:∶N∶∶∶N∶ B.CO2分子的结构式:O=C=O
C.Na的原子结构示意图:
 D.钙离子的电子式:Ca2+
D.钙离子的电子式:Ca2+难度: 简单查看答案及解析
-
可逆反应2SO2+O2
 2SO3达到平衡的标志是
2SO3达到平衡的标志是①消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A.①② B.①③ C.只有③ D.全部
难度: 简单查看答案及解析
-
在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8 mol /L和5.4 mol /L,在一定的条件下它们反应生成NH3,10 min后测得N2的浓度是0.8 mol /L,则在这10 min内用NH3来表示的平均反应速率是
A.0.1 mol /(L·min) B.0.2 mol /(L·min)
C.0.3 mol /(L·min) D.0.6 mol /(L·min)
难度: 简单查看答案及解析
-
下列微粒半径大小比较正确的是( )
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S
D.Ca<Rb<K<Na
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列叙述正确的是
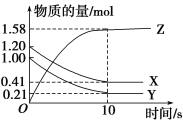
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)
 Z(g)
Z(g)难度: 简单查看答案及解析
-
已知可逆反应2SO2+ O2
 2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )A.Q1 <
 B.Q1 =
B.Q1 =  C.2Q1 > Q D.无法判断
C.2Q1 > Q D.无法判断难度: 中等查看答案及解析
-
在离子RO
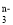 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )A.A–x+n+48 B.A–x+n+24 C.A–x-n–24 D.A+x-n–24
难度: 简单查看答案及解析

 CH3OH(g),经过5min后达到平衡状态。若此时测得甲醇蒸汽的浓度为2mol/L,求:
CH3OH(g),经过5min后达到平衡状态。若此时测得甲醇蒸汽的浓度为2mol/L,求: