-
已知某反应aX(g)+bY(g)=cZ(g)的各物质浓度数据如下:
X
Y
Z
起始浓度(mol∙L-1)
0.3
0.5
0
5s末浓度(mol∙L-1)
0.1
0.4
0.3
据此可推算出上述化学方程式中X、Y、Z三种物质的化学计量数之比是( )
A.2:1:3
B.3:1:2
C.1:4:3
D.3:2:1
难度: 简单查看答案及解析
-
下列有关化学反应的热现象的说法正确的是( )
A.化学反应中的能量变化都表现为热量变化
B.化学反应发生过程中一定有能量变化
C.能量变化必然伴随化学变化的发生
D.化学反应中能量的变化量与参加反应的物质的物质的量无关
难度: 简单查看答案及解析
-
下列有关海洋资源的综合利用说法错误的是
A.从海水中提取溴单质的工艺流程中包含了富集过程
B.海水的淡化方法主要有蒸馏法、离子交换法、过滤法等
C.海底的资源非常丰富,含有铁、锰、钴等多种金属结核矿
D.开发海洋资源不能破坏环境,应遵循绿色环保的思想
难度: 简单查看答案及解析
-
下列化学用语表述不正确的是( )
A.含6个中子的碳原子的核素符号:
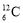
B.CCl4的电子式:

C.Cl-的结构示意图:

D.NH3的结构式:
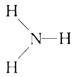
难度: 简单查看答案及解析
-
下列反应属于氮的固定的是( )
A.3NO2+H2O=2HNO3+NO
B.2NO+O2=2NO2
C.N2+O2
 2NO
2NOD.4NH3+5O2
 4NO+6H2O
4NO+6H2O难度: 简单查看答案及解析
-
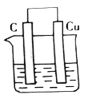
下列装置能构成原电池的是( )
A.
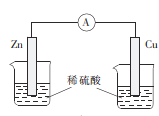 B.
B.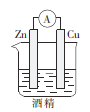
C.
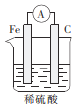 D.
D.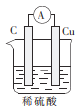
难度: 简单查看答案及解析
-
下列每组物质中含有的化学键类型完全相同的是( )
A.NaCl、HCl、NaOH B.Na2S、HCN、H2S
C.CO2、H2O、CS2 D.Na2S、O2、H2
难度: 简单查看答案及解析
-
下列措施一定不能增大化学反应速率的是( )
A.降低温度 B.增加固体反应物的量
C.固体块状的反应物改为粉末状 D.压缩容器体积增大压强
难度: 简单查看答案及解析
-
下列物质的结构、性质的比较中不正确的是( )
A.酸性:HClO4>H2SO4>H3PO4 B.热稳定性:HI<HBr<HCl<HF
C.碱性:KOH>NaOH>Al(OH)3 D.粒子半径:Na+<Mg2+<Al3+
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.SO2作为食品添加剂时应注意使用范围和使用的最大限量
B.NH3溶于水显弱碱性,因此可使石蕊溶液变红
C.含硫燃料的燃烧是空气中SO2含量增多的主要原因
D.大多数铵盐都易溶于水,受热易分解,与碱反应会放出氨
难度: 简单查看答案及解析
-
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15mol∙L-1∙s-1 ②v(B)=0.6mol∙L-1∙s-1 ③v(C)=0.5mol∙L-1∙s-1 ④v(D)=0.45mol∙L-1∙s-1。下列表示该反应进行由快到慢的顺序正确的是( )
A.②③④① B.④③②① C.③④②① D.②④③①
难度: 简单查看答案及解析
-
一定温度下,向
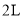 恒容密闭容器中充入
恒容密闭容器中充入 和
和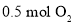 ,发生反应
,发生反应 。
。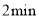 后,
后, 的浓度为
的浓度为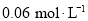 。下列有关说法不正确的是( )
。下列有关说法不正确的是( )A.
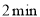 末,用
末,用 表示的反应速率为
表示的反应速率为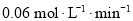
B.
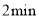 末,
末,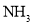 的浓度为
的浓度为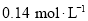
C.
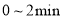 内,生成的水的质量为
内,生成的水的质量为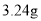
D.
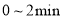 内,
内,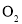 的物质的量减少了
的物质的量减少了
难度: 中等查看答案及解析
-
下列有关说法中正确的是( )
A.在稀硫酸中加入铜粉,铜粉不溶解,说明铜不和任何酸反应
B.检验久置在空气中的Na2SO3溶液是否变质可先加入HNO3溶液,再加BaCl2溶液来检验
C.锌与稀硝酸反应可以得到氢气
D.大量的二氧化硫和二氧化氮排放到空气中都能形成酸雨
难度: 简单查看答案及解析
-
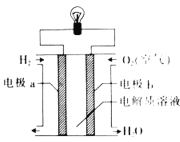
鱼雷采用的Al-Ag2O动力电池是以溶有KOH的流动海水为电解液,电池反应为2Al+3Ag2O+2KOH=6Ag+2KAlO2+H2O,下列说法正确的是( )
A.Ag2O在原电池正极被氧化
B.负极的电极反应式为Al+4OH--3e-=
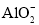 +2H2O
+2H2OC.电子由Ag2O极经外电路流向Al极
D.此电池中电能可100%转化为化学能
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.根据两种金属在反应中失去电子的难易程度,可判断两种元素金属性的强弱
B.在
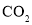 、
、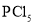 中各原子最外层均达到8电子稳定结构
中各原子最外层均达到8电子稳定结构C.原子中,质子数与核外电子数、核内中子数均相等
D.外层只有1个电子的原子都是金属原子
难度: 简单查看答案及解析
-
下列反应对应的离子方程式正确的是( )
A.将过量的铁粉加入稀硝酸中:3Fe+4H++
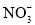 =3Fe3++NO↑+2H2O
=3Fe3++NO↑+2H2OB.亚硫酸与次氯酸钠反应:H2SO3+ClO-=HClO+
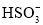
C.向碳酸氢铵溶液中加入过量的NaOH溶液:
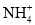 +OH-=NH3∙H2O
+OH-=NH3∙H2OD.Cu2O与足量稀硝酸反应:3Cu2O+14H++2
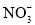 =6Cu2++2NO↑+7H2O
=6Cu2++2NO↑+7H2O难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,X、Y、Z同周期且X的原子半径是短周期主族元素原子中最大的,W、Y、Z的相对位置如图。其中Z的单质在常温下是气体。下列说法正确的是( )
W
Y
Z
A.简单离子半径:W<Y<Z B.化合物XZW可作消毒剂
C.化合物X2Y中含有共价键 D.最简单氢化物的沸点:W<Y
难度: 简单查看答案及解析
-
碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应方程式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法正确的是( )
A.电池工作时,OH-向正极移动
B.电池工作时,MnO2得电子被氧化
C.电池工作过程中,KOH的浓度在不断减小
D.理论上,锌的质量减小6.5g,通过外电路的电子为0.2mol
难度: 简单查看答案及解析
-
已知:C(s)的燃烧热△H = —393.5kJ·mol—1,C(s)+
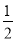 O2 (g) = CO(g) △H = —110.5kJ·mol—1。测得某次实验中m g炭粉燃烧所得气体中,CO 和 CO2的体积比为1:2,则与这些炭完全燃烧(只生成CO2)相比较,损失的能量是
O2 (g) = CO(g) △H = —110.5kJ·mol—1。测得某次实验中m g炭粉燃烧所得气体中,CO 和 CO2的体积比为1:2,则与这些炭完全燃烧(只生成CO2)相比较,损失的能量是A.
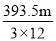 kJ B.
kJ B. kJ C.
kJ C.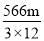 kJ D.
kJ D.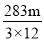 kJ
kJ难度: 中等查看答案及解析
-
常温下,由
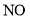 、
、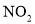 、
、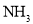 、
、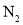 四种气体组成的混合物,在催化剂的作用下,加热充分反应后,恢复至常温,仅剩一种无色无味无毒的气体。则混合气体中各气体的体积之比
四种气体组成的混合物,在催化剂的作用下,加热充分反应后,恢复至常温,仅剩一种无色无味无毒的气体。则混合气体中各气体的体积之比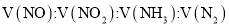 可能为( )
可能为( )A.1∶2∶3∶5 B.3∶2∶5∶4 C.4∶1∶4∶3 D.2∶3∶4∶1
难度: 简单查看答案及解析