-
要检验某溴乙烷中的溴元素,正确的实验方法是( )
A.加入氯水振荡,观察水层是否有红棕色溴出现
B.滴入AgNO3溶液,再加入稀HNO3呈酸性,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成
难度: 中等查看答案及解析
-
根据下列实验操作,预测的实验现象和实验结论或解释正确的是
实验操作
预测实验现象
实验结论或解释
A
向NaBr溶液中滴入少量的氯水和苯,振荡、静置
溶液上层呈橙红色
Br-还原性强于Cl-
B
向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热
有砖红色沉淀生成
葡萄糖具有还原性
C
白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液
无明显现象
该过程未发生原电池反应
D
向饱和Na2CO3溶液中逐滴滴加少量稀盐酸
立即有气体逸出
CO32-+2H+=H2O+ CO2↑
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列说法不正确的是
A.碘酒可使蛋白质变性,故能消毒杀菌
B.天然氨基酸能溶于强酸或强碱溶液,是两性化合物
C.食盐、糖、醋可作调味剂,不可用作食品防腐剂
D.船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是 ( )
A.在标准状况下,22.4 L C2H6中含共价键的数目为6 NA
B.5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA
C.常温下,1 L 0.1 mol·L–1 CH3COONa溶液中CH3COO-离子数目为0.1 NA
D.在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L
难度: 中等查看答案及解析
-
下列说法正确的是
A.在25℃、101KPa,1molS(s)和2molS(s)的燃烧热相等
B.1molH2SO4(浓)与1molBa(OH)2完全中和所放出的热量为中和热
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101KPa时,1molH2燃烧所放出的热量为氢气的燃烧热
难度: 中等查看答案及解析
-
中国女药学家屠呦呦因创制新型抗疟药———青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖。下列有关青蒿素的叙述错误的是
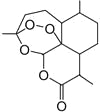
A.青蒿素的同分异构体中不可能含既有苯环又含有羧基
B.易溶于C2H5OC2H5
C.氧原子化合价有-1和-2
D.能与NaOH溶液反应
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.Na2SO3溶液加水稀释后,pH和KW均减小
B.0.1mol•L﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.浓度分别为0.2mol•L﹣1和0.1mol•L﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D.室温下,pH=12的氨水与pH=2的H2SO4溶液等体积混合后,溶液呈酸性
难度: 困难查看答案及解析
-
T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
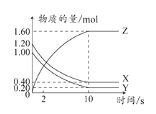
A.平衡时X、Y的转化率相同
B.达到平衡后将容器体积压缩为1 L平衡向正反应方向移动
C.T ℃时,该反应的化学方程式为X(g)+Y(g)
 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40D.T ℃时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率约为60%
难度: 中等查看答案及解析
-
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
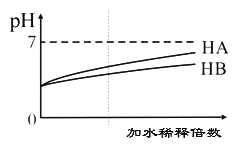
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
难度: 困难查看答案及解析
-
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
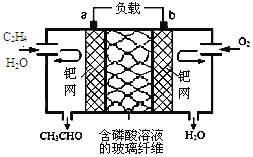
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
难度: 中等查看答案及解析
-
下列实验方案、现象和结论均正确的是
A.向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 该装置的气密性良好

B.脱脂棉燃烧 Na2O2与水反应生成氢氧化钠和氧气

C.烧杯①的澄清石灰水先变浑浊 NaHCO3比Na2CO3受热更易分解

D.U形管右端的液面高 铁钉发生吸氧腐蚀

难度: 中等查看答案及解析
-
下图是几种常见有机物之间的转化关系,有关说法正确的是
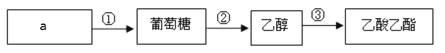
A.a只能是淀粉 B.反应①②③均为取代反应
C.乙醇可以与多种氧化剂发生氧化反应 D.乙酸乙酯的羧酸类同分异构体只有1种
难度: 简单查看答案及解析
-
下列有关实验或操作的叙述正确的是
A.
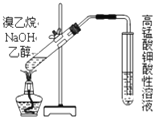 检验溴乙烷与NaOH水溶液共热产生的乙烯
检验溴乙烷与NaOH水溶液共热产生的乙烯B.
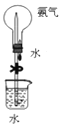 做喷泉实验时先挤压胶头滴管,后松开止水夹
做喷泉实验时先挤压胶头滴管,后松开止水夹C.酸碱中和滴定前,滴定管和锥形瓶在用蒸馏水洗涤后均需用待装溶液润洗
D.用托盘天平称取1.06g无水碳酸钠,溶于250mL水,配制0.04mol∙L-1 Na2CO3溶液
难度: 简单查看答案及解析
-
新制氢氧化铜存在平衡:Cu(OH)2 +2OH-⇌
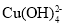 (深蓝色)。某同学进行下列实验:
(深蓝色)。某同学进行下列实验: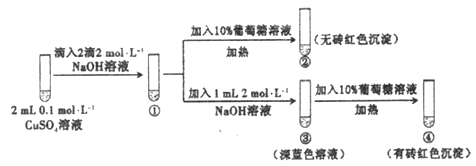
下列说法不正确的是
A.①中出现蓝色沉淀
B.③中现象是Cu(OH)2 +2OH-⇌
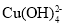 正向移动的结果
正向移动的结果C.④中现象证明葡萄糖具有还原性
D.对比②和④可知Cu(OH)2氧化性强于
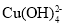
难度: 中等查看答案及解析
-
科学家研制的一种使沙漠变绿洲的新技术,即在沙漠中喷洒一定量的聚丙烯酸酯
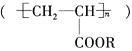 与水的混合物,使其与沙粒结合,形成既能阻止地下的盐分上升,又能拦截、蓄积雨水的作用。下列对聚丙烯酸酯的叙述中正确的是( )
与水的混合物,使其与沙粒结合,形成既能阻止地下的盐分上升,又能拦截、蓄积雨水的作用。下列对聚丙烯酸酯的叙述中正确的是( )①聚丙烯酸酯的单体的结构简式为CH2=CHCOOR
②聚丙烯酸酯没有固定的熔、沸点
③聚丙烯酸酯能发生加成反应
④合成聚丙烯酸酯的反应属于缩聚反应
A.③④ B.①②
C.①②③ D.①②③④
难度: 中等查看答案及解析
-
对可逆反应 4NH3(g)+5O2(g)
 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成 n mol NO 的同时,消耗 n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
难度: 简单查看答案及解析
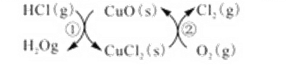
 H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1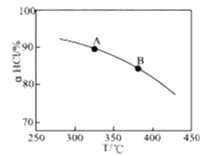
 Cu2++5Fe2++2S。
Cu2++5Fe2++2S。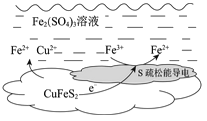
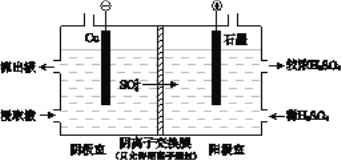
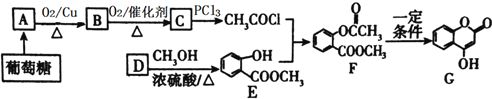
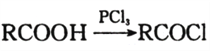
 C的化学反应方程式:_______________________________。
C的化学反应方程式:_______________________________。