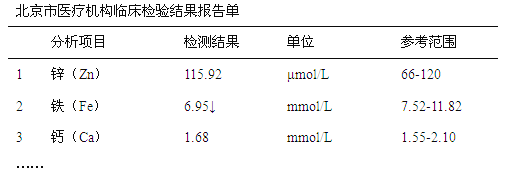
-
某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的( )
①钠比水轻 ②钠的熔点较低 ③钠与水反应在时要放出热量 ④钠与水反应后溶液呈碱性
A.①④ B.①②④ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
中华民族有着光辉灿烂的历史,下列有关描述不涉及氧化还原反应的是
A.烧铁器淬于胆矾水中,即成铜色也
B.丹砂(HgS)烧之成水银,积变又还成丹砂
C.爆竹声中一岁除,春风送暖入屠苏
D.只要功夫深,铁杵磨成针
难度: 简单查看答案及解析
-
下列物质中,属于电解质的是
A.NaOH固体 B.NaCl溶液 C.Cu D.石墨
难度: 简单查看答案及解析
-
当光束通过下列分散系时,可能产生丁达尔效应的是
A.醋酸溶液 B.Fe(OH)3胶体 C.医用酒精 D.CuSO4溶液
难度: 简单查看答案及解析
-
我国科学家参与研制的阿尔法磁谱仪随美国发现号航天飞机升入太空,开始了探索宇宙中是否存在“反物质”和“暗物质"的研究工作。根据所学的知识推测制造阿尔法磁谱仪核心部件的材料是
A.Fe B.FeO C.Fe2O3 D.Fe3O4
难度: 简单查看答案及解析
-
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
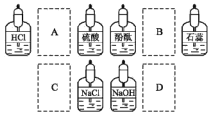
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
2022年世界冬奥会和冬残奥会在北京举行,其中短道速滑项目队员所穿的速滑冰刀可用不锈钢制成。

下列叙述错误的是
A.不锈钢是最常见的一种合金钢
B.不锈钢中常添加镍(Ni)和铬(Cr)元素,从而使其具有特殊性能
C.不锈钢中只含有金属元素,不含有非金属元素
D.不锈钢是通过增加原子层之间的相对滑动难度,导致合金的硬度变大
难度: 简单查看答案及解析
-
下列说法中错误的是
A.
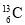 —NMR(核磁共振)可用于含碳化合物的结构分析,
—NMR(核磁共振)可用于含碳化合物的结构分析,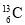 的中子数为6
的中子数为6B.Se是人体必需的微量元素,
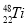 和
和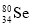 互为同位素
互为同位素C.某些花岗石产生氡(
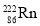 ),从而对人体产生伤害,
),从而对人体产生伤害,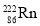 的质量数是222
的质量数是222D.原子结构示意图
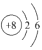 既可以表示16O,也可以表示18O
既可以表示16O,也可以表示18O难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列判断正确的是
A.常温常压下,18 g H2O所含的原子数为3NA
B.常温常压下,22.4 L N2含有的分子数为NA
C.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D.0.1 mol Na2O2含有的离子总数为0.4NA
难度: 简单查看答案及解析
-
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3: 2: 1时,三种溶液中Cl-的物质的量浓度之比为
A.1:1:1 B.1:2:3 C.3:2:1 D.3:4:3
难度: 简单查看答案及解析
-
化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系错误的是
选项
用途
性质或原理
A
Na2O2常用作潜水艇或呼吸面具的供氧剂
Na2O2与H2O、CO2反应产生O2
B
自来水厂用氯气来杀菌、消毒
氯气(Cl2)具有强氧化性
C
工业上常用绿矾(FeSO4·7H2O)处理废水中含有的重铬酸根离子(
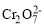 )
)Fe2+具有还原性
D
用小苏打治疗胃酸过多
NaHCO3可中和胃酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列物质①Al;②Na2CO3;③Al2O3; ④Mg(OH)2; ⑤Al(OH)3中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
A.①③⑤ B.①②④ C.②③⑤ D.①③④
难度: 简单查看答案及解析
-
分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A.H2SO4是酸,因为H2SO4中含有氢元素
B.豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C.Na和H2O的反应不是离子反应,因为反应中没有离子参加
D.Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧
难度: 中等查看答案及解析
-
下列说法中正确的是
A.单质碘中含有极性共价键
B.H、D、T互为同素异形体
C.只有金属单质灼烧时火焰才有颜色
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
难度: 简单查看答案及解析
-
下列化学反应的离子方程式正确的是
A.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O
B.碳酸钙与稀盐酸反应:
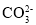 +2H+=CO2↑+H2O
+2H+=CO2↑+H2OC.Cl2与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++
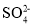 +H++OH-=BaSO4↓+H2O
+H++OH-=BaSO4↓+H2O难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、Cu2+、Cl-、
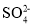
B.无色透明的溶液中:K+、Fe3+、Ba2+、
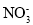
C.含有
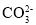 的溶液中:Na+、K+、H+、C1-
的溶液中:Na+、K+、H+、C1-D.强酸性溶液中:Na+、Al3+、
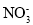 、
、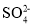
难度: 简单查看答案及解析
-
2019年2月16日,在室内巡回赛伯明翰站男子60米决赛中,苏炳添顶住了世界高手所给的压力,他以6秒47获得了本赛季的第二冠。
田径运动会上使用的发令枪所用“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式为5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是
A.上述反应中Cl的化合价由+5价变为-1价
B.P2O5是P被还原后所得的产物
C.该反应的氧化剂与还原剂的物质的量之比为5:6
D.上述反应中消耗3 mol P时,转移15 mol e-
难度: 简单查看答案及解析
-
已知下述三个实验均能发生化学反应:
①
②
③
将铁钉放入硫酸铜溶液中
向硫酸亚铁溶液中滴入几滴氯水
将铜丝放入氯化铁溶液中
下列判断错误的是
A.实验①中铁钉只做还原剂 B.实验②中发生了氧化还原反应
C.实验③中发生的是置换反应 D.上述实验证明氧化性:Cl2>Fe3+>Cu2+>Fe2+
难度: 简单查看答案及解析
-
元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是
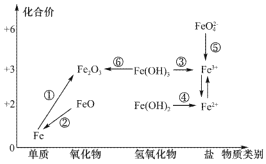
A.铁与高温水蒸气的反应可实现上述转化
B.加热Fe(OH)3发生转化⑥,Fe2O3加水溶解可转化为Fe(OH)3
C.由图可预测:高铁酸盐(FeO42- )具有强氧化性,可用于饮用水的消毒
D.FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe2O3
难度: 简单查看答案及解析
-
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是
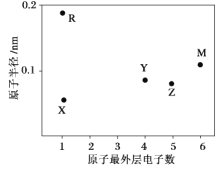
A.M在元素周期表中的位置为:第三周期第VIA族
B.X和Y形成的化合物YX4为平面结构
C.R的氧化物一定含有离子键和共价键
D.最高价含氧酸的酸性:Z<Y
难度: 简单查看答案及解析